题目内容
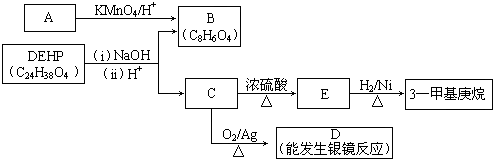
10.氢化阿托醛(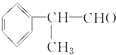 )是一种重要的化工原料,其合成路线如下
)是一种重要的化工原料,其合成路线如下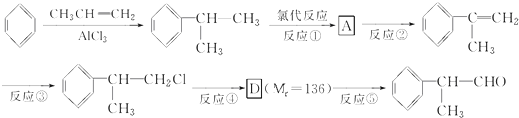
(1)在合成路线上①~⑤反应中,属于消去反应的有②(填反应序号).
(2)写出反应④的化学方程式
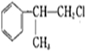 +NaOH→水△
+NaOH→水△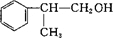 +NaCl.
+NaCl.(3)写出氢化阿托醛与新制氢氧化铜反应的化学方程式
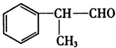 +2Cu(OH)2△→
+2Cu(OH)2△→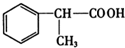 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.(4)氢化阿托醛具有的性质是cd(选填序号).
a.易溶于水 b.通常状况下呈气态 c.可发生还原反应 d.可发生银镜反应 e.遇FeCl3溶液显紫色
(5)写出满足下述两个条件的D的同分异构体的结构简式:
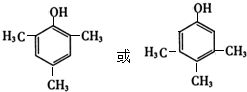 .
.a.遇FeCl3溶液显紫色
b.苯环上的一氯取代物只有一种结构.
(6)请写出以
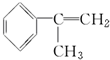 为原料制备
为原料制备 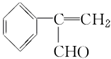 的化学方程式(无机试剂任用).
的化学方程式(无机试剂任用). +Br2→
+Br2→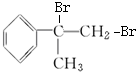 、
、 +2NaOH→水△
+2NaOH→水△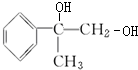 +2NaBr、
+2NaBr、2
 +O2→Cu△2
+O2→Cu△2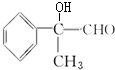 +2H2O、
+2H2O、 →浓硫酸△
→浓硫酸△ +H2O.
+H2O.
分析 由苯与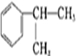 的结构可知,苯和CH3CH=CH2在AlCl3作用下发生加成反应生成
的结构可知,苯和CH3CH=CH2在AlCl3作用下发生加成反应生成 ,与氯气发生取代反应生成氯代烃,由
,与氯气发生取代反应生成氯代烃,由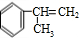 结构可知反应②为消去反应,结合转化关系可知A为
结构可知反应②为消去反应,结合转化关系可知A为 ,反应③
,反应③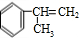 生成
生成 ,C=C键变为C-C键,为
,C=C键变为C-C键,为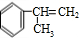 与HCl发生加成反应,D的相对分子质量为136,D在催化剂作用下可被氧化为
与HCl发生加成反应,D的相对分子质量为136,D在催化剂作用下可被氧化为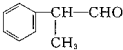 ,说明D中含有-OH,可被氧化,则D应为
,说明D中含有-OH,可被氧化,则D应为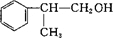 ,则反应④为
,则反应④为 在NaOH水溶液、加热条件下的水解反应生成醇,以此解答(1)~(5);
在NaOH水溶液、加热条件下的水解反应生成醇,以此解答(1)~(5);
(6)中 与溴发生加成反应生成
与溴发生加成反应生成 ,再在氢氧化钠水溶液、加热条件下发生水解反应生成
,再在氢氧化钠水溶液、加热条件下发生水解反应生成 ,然后发生催化氧化生成
,然后发生催化氧化生成 ,最后在浓硫酸、加热条件下发生消去反应得到
,最后在浓硫酸、加热条件下发生消去反应得到 ,据此解答.
,据此解答.
解答 解:由苯与 的结构可知,苯和CH3CH=CH2在AlCl3作用下发生加成反应生成
的结构可知,苯和CH3CH=CH2在AlCl3作用下发生加成反应生成 ,与氯气发生取代反应生成氯代烃,由
,与氯气发生取代反应生成氯代烃,由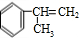 结构可知反应②为消去反应,结合转化关系可知A为
结构可知反应②为消去反应,结合转化关系可知A为 ,反应③
,反应③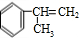 生成
生成 ,C=C键变为C-C键,为
,C=C键变为C-C键,为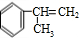 与HCl发生加成反应,D的相对分子质量为136,D在催化剂作用下可被氧化为
与HCl发生加成反应,D的相对分子质量为136,D在催化剂作用下可被氧化为 ,说明D中含有-OH,可被氧化,则D应为
,说明D中含有-OH,可被氧化,则D应为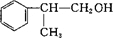 ,则反应④为
,则反应④为 在NaOH水溶液、加热条件下的水解反应生成醇.
在NaOH水溶液、加热条件下的水解反应生成醇.
(1)在合成路线上①~⑤反应中,反应①④为取代反应,②为消去反应、③为加成反应、⑤为氧化反应,故答案为:②;
(2)反应④的化学方程式: +NaOH→水△
+NaOH→水△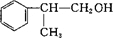 +NaCl,故答案为:
+NaCl,故答案为: +NaOH→水△
+NaOH→水△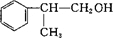 +NaCl;
+NaCl;
(3)氢化阿托醛与新制氢氧化铜反应的化学方程式为: +2Cu(OH)2△→
+2Cu(OH)2△→ +Cu2O↓+2H2O,
+Cu2O↓+2H2O,
故答案为: +2Cu(OH)2△→
+2Cu(OH)2△→ +Cu2O↓+2H2O;
+Cu2O↓+2H2O;
(4)氢化阿托醛具有苯环,不易溶于水,通常状况下不呈气态,含有苯环与醛基,可以与氢气发生加成反应,属于还原反应,含有醛基,可以发生银镜反应,没有酚羟基,遇FeCl3溶液不显紫色,
故答案为:cd;
(5)满足下述两个条件的D(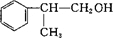 )的同分异构体:a.遇FeCl3溶液显紫色,含有酚羟基;b.苯环上的一氯取代物只有一种结构,应含有3个甲基、1个酚羟基,且为对称结构,符合条件的同分异构体为
)的同分异构体:a.遇FeCl3溶液显紫色,含有酚羟基;b.苯环上的一氯取代物只有一种结构,应含有3个甲基、1个酚羟基,且为对称结构,符合条件的同分异构体为 ,
,
故答案为: ;
;
(6) 与溴发生加成反应生成
与溴发生加成反应生成 ,再在氢氧化钠水溶液、加热条件下发生水解反应生成
,再在氢氧化钠水溶液、加热条件下发生水解反应生成 ,然后发生催化氧化生成
,然后发生催化氧化生成 ,最后在浓硫酸、加热条件下发生消去反应得到
,最后在浓硫酸、加热条件下发生消去反应得到 ,相应的反应方程式为:
,相应的反应方程式为: +Br2→
+Br2→ ,
, +2NaOH→水△
+2NaOH→水△ +2NaBr,
+2NaBr,
2 +O2→Cu△2
+O2→Cu△2 +2H2O,
+2H2O, →浓硫酸△
→浓硫酸△ +H2O,
+H2O,
故答案为: +Br2→
+Br2→ 、
、 +2NaOH→水△
+2NaOH→水△ +2NaBr、
+2NaBr、
2 +O2→Cu△2
+O2→Cu△2 +2H2O、
+2H2O、 →浓硫酸△
→浓硫酸△ +H2O.
+H2O.
点评 本题考查有机物的合成与推断,结合反应条件及反应物、生成物的结构特点推断,需要学生熟练掌握官能团的性质与转化,难度中等.

 普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )| A. | 能与FeCl3 溶液发生显色反应 | |
| B. | 能使酸性KMnO4 溶液褪色 | |
| C. | 能发生加成、取代,不能消去反应 | |
| D. | 1 mol 该物质最多可与1 mol NaOH 反应 |
| A. | 金属钠在空气中加热,生成淡黄色固体:2Na+O2═Na2O2 | |
| B. | 向硫酸铝溶液中加入氨水制备氢氧化铝:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| C. | 铁在潮湿的环境中生锈:3Fe+4H2O=Fe3O4+H2↑ | |
| D. | 二氧化氮溶于水有硝酸生成:3NO2+H2O=2HNO3+NO |
| A. | ①、④溶液中水电离的c( H+):①>④ | |
| B. | 将②、③溶液混合后pH=7,则消耗溶液的体积:②<③ | |
| C. | 分别向等体积的上述溶液中加入100 ml,水,溶液的pH:③>④>①>② | |
| D. | 将①、④溶液混合后pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7mol•L-1 |
| A. | 食盐和金属钠的熔化 | B. | 氯化铵和单质硫的熔化 | ||
| C. | 碘和干冰的升华 | D. | 金刚石和石灰石的熔化 |

回答下列问题:
(1)初沉池中加入的混凝剂是明矾,用于吸附悬浮杂质,用离子方程式表示其道理Al3++3H2O?Al(OH)3+3H+.
(2)若在化学实验室中模拟第②步操作A,则进行该操作所需的玻璃仪器为烧杯、漏斗、玻璃棒.
(3)已知在其中第③步存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O
若平衡体系的pH=1,该溶液是橙色;能说明第③步反应达平衡状态的是C(填序号).
A.Cr2O72-与CrO42-的浓度相同
B.2v(Cr2O72-)=v(CrO42-)
C.溶液的颜色不变
(4)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,且有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀时的pH | 9.0 | 3.2 | 5.6 |
A.Na2O2 B.Ba(OH)2 C.NaOH
此时溶液pH的范围在B(填序号)最好.
A.3-4 B.6-8 C.10-11 D.12-14.
(5)若按照(4)题方法处理Cr2O72-,则处理该溶液中0.1molCr2O72-时,理论上可生成沉淀的质量为84.8g.
(6)工业上还可以用石墨作电极,电分解Na2CrO4的酸性废水来生产金属铬,写出生成金属铬的电极反应式CrO42-+8H++6e-=Cr+4H2O.

| A. | 三氯生的分子式为:C12H6Cl3O2 | |
| B. | 三氯甲烷只有一种结构,可推知CH4是正四面体 | |
| C. | 三氯生能与NaOH溶液反应 | |
| D. | 常温下,三氯生易溶于水 |
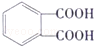
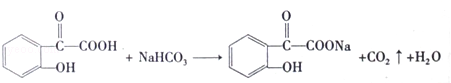
 SO2在物质的研究和制备过程中有重要的用途,既可以作为原料又可作为溶剂,请回答下列问题:
SO2在物质的研究和制备过程中有重要的用途,既可以作为原料又可作为溶剂,请回答下列问题: .
.
 .
. .
. .
.