题目内容
【题目】实验室需要0.1mol·L-1 NaOH溶液450 mL。根据溶液的配制情况回答下列问题。
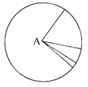
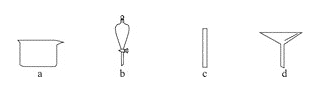
(1)在下图所示仪器中,配制上述溶液肯定不需要的是 _____________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器 _____________________。
(2)配制时,其正确的操作顺序是(用字母表示,每个操作只用一次) __________。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(3)实验两次用到玻璃棒,其作用分别是:先用于 ______,后用于 ________。
(4)关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是 ________。
A.①②③④ B.②③ C.①②④ D.②③④
(5)根据计算用托盘天平称取的质量为 ____________g。
(6)下列操作配制的溶液浓度偏低的是______。
A.称量NaOH时,将NaOH放在纸上称重
B.配制前,容量瓶中有少量蒸馏水
C.配制时,NaOH未冷却直接定容
D.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
E.定容时俯视刻度线
【答案】bd 500 mL容量瓶、胶头滴管 BCAFED 搅拌 引流 A 2.0 AD
【解析】
(1)配制一定物质的量浓度的溶液需要烧杯、玻璃棒、容量瓶、胶头滴管等,因此不需要的是分液漏斗和漏斗,即bd;由于没有450mL规格的容量瓶,因此配制上述溶液还需要的玻璃仪器为500 mL容量瓶、胶头滴管;
(2)配制一定物质的量浓度溶液的过程为计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,即BCAFED;
(3)实验中第一次使用玻璃棒的作用为:搅拌;第二次使用玻璃棒的作用为:引流;
(4)①容量瓶是用于配制准确浓度溶液的仪器,故正确;
②容量瓶不宜贮存溶液,故正确;
③容量瓶不能用来加热,故正确;
④容量瓶使用之前要检查是否漏水,故正确;
故答案选A;
(5)由于需要配制500mL的氢氧化钠溶液,因此需要的氢氧化钠的质量为0.5L×0.1mol/L×40g/mol=2.0g;
(6)A.称量NaOH时,将NaOH放在纸上称重,由于氢氧化钠易潮解,因此氢氧化钠的物质的量偏小,故浓度偏低;
B.配制前,容量瓶中有少量蒸馏水,对溶液体积以及溶质的物质的量无影响,故浓度不变;
C.配制时,NaOH未冷却直接定容,由于冷却后液体体积偏小,故物质的量浓度偏大;
D.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面,溶质的物质的量偏小,物质的量浓度偏低;
E.定容时俯视刻度线,溶液体积偏小,物质的量浓度偏大。
故答案选AD。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案