题目内容
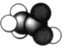
【题目】(题文)有X、Y、Z三种短周期元素,原子半径大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质分子在适当条件下可发生如图变化,其中B和C均为10电子分子.下列说法中不正确的是
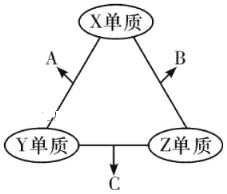
A. X与Z形成的某种化合物可用来杀菌消毒 B. C极易溶于B中,溶液呈碱性
C. Y与Z形成的二元化合物只含有极性键 D. A和C能发生氧化还原反应
【答案】C
【解析】
根据10电子分子可围绕常见氢化物分析,根据原子序数结合原子半径,可知Z是氢、X是氧、Y是氮,A、X与Z形成的某种化合物H2O2可用来杀菌消毒,故A正确;B、C是NH3,极易溶于B——H2O中,溶液呈碱性,故B正确;C、Y与Z形成的二元化合物可能是NH3只含有极性键,也可能是N2H4其中N―H是极性键,N―N是非极性键,故C错误;D、NO和NH3能发生氧化还原反应,故D正确。故选C。

【题目】一定温度下,在3个1.0 L的恒容密闭容器中分别进行反应2X(g)+Y(g)![]() Z(g) ΔH,达到平衡。相关数据如下表。
Z(g) ΔH,达到平衡。相关数据如下表。
容器 | 温度/K | 物质的起始浓度/ mol·L-1 | 物质的平衡浓度/ mol·L-1 | ||
c(X) | c(Y) | c(Z) | c(Z) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | a |
III | 500 | 0.20 | 0.10 | 0 | 0.025 |
下列说法不正确的是
A. 平衡时,X的转化率:II>I
B. 平衡常数:K(II)>K(I)
C. 达到平衡所需时间:III<I
D. 反应的ΔH<0
【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
写出CO2催化氢化合成甲醇的热化学方程式:_______。
(2)为提高CH3OH产率,理论上应采用的条件是_______(填字母)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
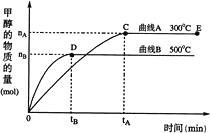
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),下图为不同投料比[n(H2)/n(CO2)]时某反应物X平衡转化率变化曲线。
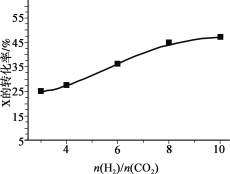
① 反应物X是_______(填“CO2”或“H2”)。
② 判断依据是_______。
(4)250℃、在体积为2.0L的恒容密闭容器中加入6mol H2、2mol CO2和催化剂,10min时反应达到平衡,测得c(CH3OH) = 0.75 mol· L-1。
① 前10min的平均反应速率v(H2)=_______ mol·L-1·min -1。
② 化学平衡常数K = _______。
③ 催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
实验编号 | 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
A | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
B | 543 | Cu/ZnO纳米片 | 11.9 | 72.7 |
C | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
D | span>553 | Cu/ZnO纳米片 | 12.0 | 70.6 |
根据上表所给数据,用CO2生产甲醇的最优选项为_______(填字母)。
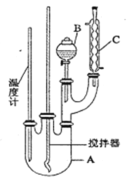
【题目】某科学小组制备硝基苯的实验装置如下,有关数据列如下表。已知存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯。
物质 | 熔点/℃ | 沸点/℃ | 密度/g.cm-1 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
实验步骤如下:
取100mL烧杯,用20 mL浓硫酸与足量浓硝酸配制混和酸,将混合酸小心加入B中。把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀。在50~60℃下发生反应,直至反应结束。
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210℃馏分,得到纯硝基苯18g。
回答下列问题:
(1)图中装置C的作用是_______________________________。
(2)制备硝基苯的化学方程式__________________________________________________。
(3)叙述配制混合酸操作:______________________________________________。
(4)为了使反应在50℃~60℃下进行,常用的方法是______________。反应结束并冷却至室温后A中液体就是粗硝基,粗硝基苯呈黄色的原因是________________________(用化学方程式说明),除去该有色物质选择的试剂是____________,分离提纯的方法为___________,涉及的离子方程式为_______________。
(5)在洗涤操作中,第二次水洗的作用是________________________________________。
(6)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用水直形冷凝管的原因是_______________________________________________________________。
(7)本实验所得到的硝基苯产率是______________________。