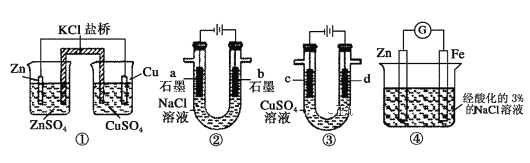
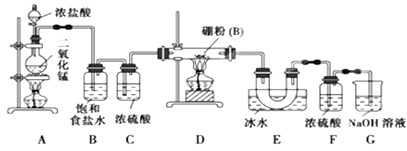
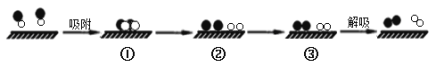
题目内容
【题目】某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图所示。
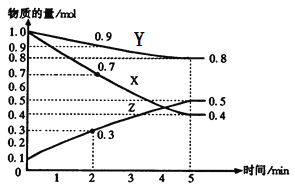
(1)由图中的数据分析,该反应的化学方程式为_____________________。
(2)反应开始至5min,Z的平均反应速率为__________;
(3)反应开始至5min,正反应速率逐渐______;(填“增大”“减小”)逆反应速率逐渐______,(填“增大”“减小”)5min后Z的物质的量不再改变,原因是下列的________;
A.正逆反应都停止了
B.正反应速率为零
C.正逆反应速率相等,反应达到平衡状态
D.逆反应速率为零
(4)下列措施一定能使正反应速率增大的是______。
A.升高温度 B.降低温度
C.增大Y的浓度 D.减少Z的浓度
【答案】3X+Y![]() 2Z 0.04 mol·(L·min)-1 减小 增大 C AC
2Z 0.04 mol·(L·min)-1 减小 增大 C AC
【解析】
(1)根据曲线的变化趋势判断反应物和生成物,根据物质的量变化之比等于化学计量数之比书写方程式;
(2)根据v=△c/△t计算反应速率;
(3)浓度越大,反应速率越大,浓度变小,反应速率变小,当达到平衡状态时,各组分量不再改变;
(4)升高温度,正逆反应速率均增大,增大组分浓度,反应速率增大。
(1)从曲线的变化趋势可以看出,从反应开始到达到平衡,X、Y的物质的量减少,应为反应物,Z的物质的量增加,应为生成物,从反应开始到第5分钟反应到达平衡状态,X、Y消耗的物质的量分别为0.6mol、0.2mol,Z的生成的物质的量为0.4mol,因此三者比例为3:1:2,物质的量变化之比等于化学计量数之比,则化学方程式为3X+Y![]() 2Z;
2Z;
(2)Z的平均反应速率v=△c/△t=(0.5mol-0.1mol)/(2L×5min)=0.04mol/(L·min);
(3)反应开始至5min,反应物X、Y的物质的量减小,生成物Z的物质的量增加,故正反应速率逐渐减小;逆反应速率逐渐增大,当达到平衡状态时,正逆反应速率相等,各组分量不再改变,故答案为:减小;增大;C;
(4)A.升高温度,正逆反应速率均增大,故A正确;
B. 降低温度,正逆反应速率均减小,故B错误;
C. 增大Y的浓度,正反应速率增大,故C正确;
D. 减少Z的浓度,正反应速率减小,故D错误。
故答案为:AC。

【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ||||||
4 | ⑧ | ⑨ | ||||||
请按要求回答下列问题。
(1)这九种元素中,原子半径最大的是(填元素符号)___;元素⑤的原子结构示意图为___。
(2)③、④、⑤三种元素中非金属性最强的元素是(填元素符号)___。
(3)元素⑤、⑦、⑨形成的气态氢化物稳定性最差的是(填写分子式)___。