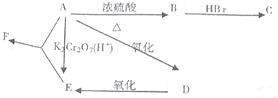
题目内容
6.一块11.0g的铁铝合金,加入一定量的稀硫酸后合金完全溶解,然后加H2O2至溶液中无Fe2+存在,加热除去多余的H2O2,当加入200mL 6mol•L-1 NaOH溶液时沉淀量最多,且所得沉淀质量为26.3g,下列说法不正确的是( )| A. | 该合金中铁的质量为5.6g | |
| B. | 合金与稀硫酸反应共生成0.45mol H2 | |
| C. | 该合金与足量氢氧化钠反应,转移的电子数为0.6NA | |
| D. | 所加的稀硫酸中含0.6molH2SO4 |
分析 200mL 6mol•L-1 NaOH溶液中含有NaOH的总物质的量为:6mol/L×0.2mol=1.2mol,生成沉淀最多时溶质为硫酸钠,则所加硫酸的物质的量为:$\frac{1.2mol}{2}$=0.6mol;
最终得到的沉淀为氢氧化铝和氢氧化铁的混合物,则生成沉淀时消耗氢氧根离子的物质的量为:$\frac{26.3g-11.0g}{17g/mol}$=0.9mol,则铁和铝的总物质的量为:$\frac{0.9mol}{3}$=0.3mol,设合金中铁的物质的量为x、铝的物质的量为y,则56x+27y=11.0、x+y=0.3,解得:x=0.1mol、y=0.2mol,据此对各选项进行判断.
解答 解:最终得到的沉淀为氢氧化铝和氢氧化铁的混合物,则生成沉淀时消耗氢氧根离子的物质的量为:$\frac{26.3g-11.0g}{17g/mol}$=0.9mol,则铁和铝的总物质的量为:$\frac{0.9mol}{3}$=0.3mol,设合金中铁的物质的量为x、铝的物质的量为y,则56x+27y=11.0、x+y=0.3,解得:x=0.1mol、y=0.2mol;
200mL 6mol•L-1 NaOH溶液中含有NaOH的总物质的量为:6mol/L×0.2mol=1.2mol,生成沉淀最多时溶质为硫酸钠,则所加硫酸的物质的量为:$\frac{1.2mol}{2}$=0.6mol;
A.根据计算可知,合金中含有0.1mol铁,其质量为:56g/mol×0.1mol=5.6g,故A正确;
B.0.1mol铁与稀硫酸反应生成0.1mol氢气,0.2mol铝与稀硫酸反应生成0.3mol氢气,总共生成0.4mol氢气,故B错误;
C.铁不与氢氧化钠溶液反应,0.2mol铝与氢氧化钠溶液反应转移电子为:0.2mol×3=0.6mol,转移的电子数为0.6NA,故C正确;
D.根据分析可知,所加硫酸的物质的量为0.6mol,故D正确;
故选B.
点评 本题考查了混合物反应的计算,题目难度中等,明确恰好沉淀时溶质组成为解答关键,注意掌握质量守恒定律、电子守恒在化学计算中的应用,试题侧重考查学生的分析、理解能力及化学计算能力;B为易错点,注意铁与稀硫酸反应生成的是硫酸亚铁.

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案| A. | 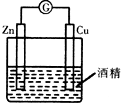 形成原电池 | B. | 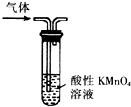 除去乙烯中混有的SO2 | ||
| C. | 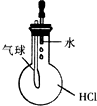 验证HCl气体在水中的溶解性 | D. | 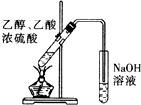 实验室制取乙酸乙酯 |
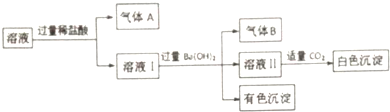
| A. | 气体A一定没有CO2,气体B一定是NH3 | |
| B. | 有色沉淀一定是混合物 | |
| C. | Na+可能存在于该溶液中 | |
| D. | 白色沉淀中一定没有Al(OH)3 |
| A. | 用pH试纸测定氯水的pH | |
| B. | 用焰色反应鉴别NaCl和KNO3 | |
| C. | 用AgNO3溶液鉴别NO2和Br2蒸气 | |
| D. | 用饱和NaHCO3溶液除去CO2中混有的HCl杂质气体 |
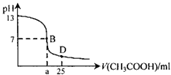 如图为常温下,向25ml某浓度的NaOH溶液中逐滴加入0.2mol•L-1CH3COOH溶液的过程中溶液pH的变化曲线,下列说法不正确的是( )
如图为常温下,向25ml某浓度的NaOH溶液中逐滴加入0.2mol•L-1CH3COOH溶液的过程中溶液pH的变化曲线,下列说法不正确的是( )| A. | NaOH溶液起始浓度为0.1mol•L-1 | |
| B. | a>12.5 | |
| C. | B点溶液中c(Na+)一定等于c(CH3COO-) | |
| D. | D点溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| A. | “地沟油”危害健康,是因为脂肪酸油脂中的碳碳双键被破坏,不利健康 | |
| B. | 浸泡过高锰酸钾溶液的硅藻土可用作水果保鲜制是因为高锰酸钾溶液可吸收水果释放的乙烯 | |
| C. | 废旧电池必须回收利用,是因为电池中的重金属等会严重污染土壤和水体 | |
| D. | 食品包装袋、食物保鲜膜通常用聚乙烯树脂,是因为聚乙烯树脂是无毒的高分子化合物 |