题目内容
【题目】能源短缺是人类社会面临的重大问题,甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)已知:CO、H2、CH3OH(g)的燃烧热分别为283kJ/mol、285.8kJ/mol、768kJ/mol。工业上一般利用合成气发生下列反应合成甲醇:CO(g)+ 2H2(g)![]() CH3OH(g)。
CH3OH(g)。
①完成该热化学方程式:CO(g)+ 2H2(g)![]() CH3OH(g)△H=______ kJ/mol;
CH3OH(g)△H=______ kJ/mol;
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,达到平衡,测得c(H2)= 2.2molL﹣1,则CO的转化率为______。
(2)T1℃时,此反应的平衡常数为K(T1)= 50。此温度下,在一个2L的密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
物质 | H2 | CO | CH3OH(g) |
浓度/(molL﹣1) | 0.2 | 0.2 | 0.4 |
①比较此时正、逆反应速率的大小:v正____v逆值(填“>”、“<”或“=”)。
②若其他条件不变,在T2℃反应l0min后又达到平衡,测得n(H2)= 0.3mol,试比较:温度T1___T2(填“>”、“=”或“<”,下同)T2℃时该反应的平衡常数K(T2)______50。
③若其他条件不变时,只改变反应的某一个条件,下列说法正确的是______。
a.若达到新平衡时c(CO)= 0.3mo1/L,平衡一定逆向移动
b.若将容器体积缩小到原来的一半,达到新平衡时,0.2mol/L<c(CO)<0.4mol/L
c.若向容器中同时加入0.4mol CO和0.8mol CH3OH(g),平衡不移动
d.若向容器中加入0.8mol CH3OH(g),达到新平衡时,CO的体积分数不变
【答案】-86.6 40% = > > bc
【解析】
(1) ①三种物质燃烧的热化学方程式为:
H2(g)+1/2O2(g)=H2O(l) H=-285.8kJ/mol ①
CO(g)+1/2O2(g)=CO2(g) H=-283.0kJ/mol ②
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) H=-768kJ/mol ③
则①×2+②-③得:CO(g)+2H2(g)![]() CH3OH(g) △H=-86.6kJ/mol。
CH3OH(g) △H=-86.6kJ/mol。
②设CO的变化量为x mol/L
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始量 1 3 0
变化量 x 2x x
平衡量 1-x 3-2x x
则3-2x=2.2,即x=0.4
CO的转化率为![]() 。
。
(2)①浓度商![]() ,说明反应达到平衡状态,所以v正=v逆。
,说明反应达到平衡状态,所以v正=v逆。
②若其他条件不变,在T2℃反应l0min后又达到平衡,测得n(H2)=0.3mol,则其浓度为0.15mol/L,与原平衡相比较氢气浓度减小,可得出平衡正向移动。对于放热反应,温度降低,平衡正向移动,从而得出T1>T2;T2℃时平衡正向移动,则该反应的平衡常数增大,K(T2)>50;
③若其他条件不变时,只改变反应的某一个条件
a.达到新平衡时c(CO)=0.3mo1/L,若为增大CO的浓度,平衡会正向移动,错误;
b.若将容器体积缩小到原来的一半,CO的浓度变为原来的2倍,达到新平衡时,浓度减小,但比原平衡时大,故0.2mol/L<c(CO)<0.4mol/L,正确;
c.若向容器中同时加入0.4mol CO和0.8mol CH3OH(g),利用浓度商进行分析,平衡不移动,正确;
d.因起始投入量之比不等于化学计量数之比,若向容器中加入0.8mol CH3OH(g),不是等效平衡,所以达到新平衡时,CO的体积分数改变,错误。
故答案为bc。

 名校课堂系列答案
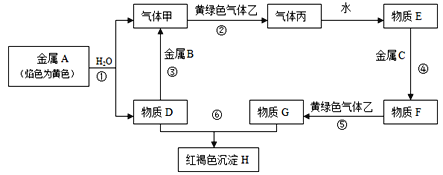
名校课堂系列答案【题目】某铁的氧化物粉末可能含有FeO、Fe2O3中的一种或两种。某化学兴趣小组为验证该氧化物粉末的组成,做了如下实验:
(1)甲同学利用1mol/L的硫酸、KSCN溶液、酸性高锰酸钾溶液来确定其组成
编号 | 实验操作 | 实验现象与结论 |
① | 取少量粉末放入试管中,注入1mol/L的硫酸 | 粉末逐渐溶解,溶液呈黄绿色 |
② | 将①中所得溶液分成两份,向其中一份滴加几滴__________,振荡 | 若溶液________ ,说明有Fe2O3存在 |
③ | 向另一份溶液中加入少量__________,振荡 | 若溶液________ ,说明有FeO存在 |
(2)乙同学称取30.4g固体,按以下步骤进行实验:
步骤一 将固体置于烧杯中,加入1mol/L的硫酸将固体完全溶解
步骤二 往烧杯中先加入足量的氯水,充分反应后再加入足量的氢氧化钠溶液
步骤三 将步骤二所得的物质过滤洗涤后,灼烧至固体质量不再变化,得到32g红棕色固体
①步骤二中加入氯水的目的是__________________________________________;
②步骤三中沉淀洗涤的操作为__________________________________________;
③原固体中FeO和Fe2O3的物质的量之比为___________________。
【题目】化学与社会、生活密切相关。下列事实和解释均正确的是( )
选项 | 事实 | 解释 |
A | 单晶硅用于制造光导纤维 | 单晶硅可使光发生全反射 |
B | 泡沫灭火器是利用 |
|
C | 利用铝热剂( | 铝置换出铁吸收能量使铁凝固 |
D | 用乙醇洗去织物上的油污 | 乙醇能与油污发生取代反应 |
A.AB.BC.CD.D