��Ŀ����
����Ŀ������������(��![]() )����������(��
)����������(��![]() )��������Ŀǰ������ѧ�о����ȵ㡣
)��������Ŀǰ������ѧ�о����ȵ㡣
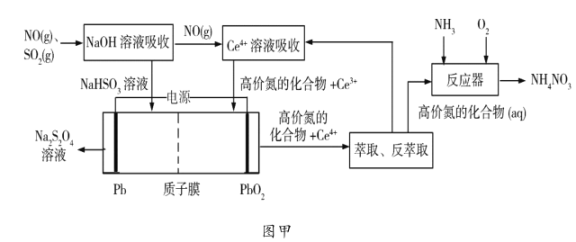
(1)��ҵ�Ͽ��Բ��á�����Ĥ���ۡ����������������������乤����ͼ����ʾ��
��![]() ��Һ����
��Һ����![]() ��Ҫ��Ӧ�Ļ�ѧ����ʽΪ___________��
��Ҫ��Ӧ�Ļ�ѧ����ʽΪ___________��
�ڵ�����ҪĿ����______________�������ĵ缫��ӦʽΪ______________��
�ۡ��۵��Ļ������NO2�ڷ�Ӧ���з������Ϸ�Ӧ�Ļ�ѧ����ʽΪ______��
(2)���û��Խ�̿���������ã����Զ����������������������������![]() ����Խ�̿��Ӧ����
����Խ�̿��Ӧ����![]() ��
��![]() ��������
��������![]() ʱ��ת�Ƶ��ӵ����ʵ���Ϊ__________
ʱ��ת�Ƶ��ӵ����ʵ���Ϊ__________![]() ��
��
(3)һ�������£���һ��Ũ��NOx(NO2��NO�Ļ������)ͨ��![]() ��
��![]() ����Һ�У������ķ�Ӧ���£�
����Һ�У������ķ�Ӧ���£�![]() ��
��![]() ���ı�
���ı�![]() ��
��![]() ��ȥ���ʱ仯�����ͼ����ʾ��
��ȥ���ʱ仯�����ͼ����ʾ��
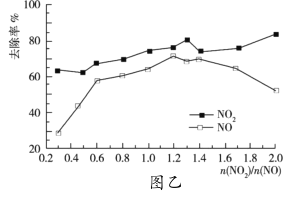
�ٵ�![]() ����1.4ʱ��
����1.4ʱ��![]() ȥ�������ߣ���
ȥ�������ߣ���![]() ��ȥ����ȴ���͡�����ܵ�ԭ����__��
��ȥ����ȴ���͡�����ܵ�ԭ����__��
��![]() ��
��![]() ��������Ҫ��ӦΪ
��������Ҫ��ӦΪ![]() ������
������![]() �ij�ʼŨ�Ȳ��䣬�ı�
�ij�ʼŨ�Ȳ��䣬�ı�![]() ������Ӧ��Ļ������ͨ��
������Ӧ��Ļ������ͨ��![]() ����Һ�����ա�Ϊ��ʡ
����Һ�����ա�Ϊ��ʡ![]() �����������ܱ���
�����������ܱ���![]() ȥ��Ч������
ȥ��Ч������![]() ���ʵ�ֵԼΪ___________��
���ʵ�ֵԼΪ___________��
(4)��֪��![]() ��
��![]() ����
����![]() ______________________��
______________________��
���𰸡�![]() ����
����![]()
![]()
![]() 8
8 ![]() ��
��![]() ��Ӧ����
��Ӧ����![]() ��
��![]() ������
������![]() ��ȥ���ʽ��� 0.6
��ȥ���ʽ��� 0.6 ![]()
��������
(1)������ͼ��֪��������ͨ������������Һ�У���������������������Һ��Ӧ����������������Һ��δ��Ӧ��һ���������뺬��Ce4+������Һ�У�һ��������Ce4+��Ӧ����Ce3+�۵��Ļ�����ڵ����У����������£������������������ϵõ����ӷ�����ԭ��Ӧ����Na2S2O4��Ce3+������ʧȥ���ӷ���������Ӧ����Ce4+��Ce4+�۵��Ļ����ᆳ����ȡ�ͷ���ȡ����õ�Ce4+�۵��Ļ����Ce4+����Ce4+������Һ��ѭ��ʹ�ã��۵��Ļ����������Һ��Ӧ�����백����������Ӧ��������泥�
(2)�������֪���������Ķ�����������Խ�̿��Ӧ���ɵ����Ͷ�����̼����Ӧ�Ļ�ѧ����ʽΪ2NO2+2C=N2+2CO2����Ϸ���ʽ�еĶ�����ϵ�������ת��������
(3)�ٵ�![]() ����1.4ʱ��NO2ȥ��Ч�����ߣ���NOȥ��Ч��ȴ��������Ϊ����������Ӧ����һ��������
����1.4ʱ��NO2ȥ��Ч�����ߣ���NOȥ��Ч��ȴ��������Ϊ����������Ӧ����һ��������
��O3��NO��Ӧ�Ļ�ѧ����ʽΪNO+O3=NO2+O2��NO��NO2������������Һ��Ӧ�Ļ�ѧ����ʽΪNO+ NO2+2OH-=2NO2-+ H2O����ͼ��֪����������һ�����������ʵ�����Ϊ1.4ʱNOxȥ��Ч����ã�
(4)�ɸ�˹���ɼ���ɵá�
(1)���ɷ�����֪����������Һ���������Ӧ�������������ƣ���Ӧ�Ļ�ѧ����ʽΪSO2+NaOH�T2NaHSO3���ʴ�Ϊ��SO2+NaOH�T2NaHSO3��
���ɷ�����֪�������Խ�����������ת��ΪNa2S2O4����Ce3+ת��ΪCe4+���ﵽCe4+����ѭ����Ŀ�ģ����������£������������������ϵõ����ӷ�����ԭ��Ӧ����Na2S2O4���缫��ӦʽΪ![]() ���ʴ�Ϊ��Ce4+������
���ʴ�Ϊ��Ce4+������![]() ��
��
�ۡ��۵��Ļ��������ж�����������Һ��Ӧ�����백����������Ӧ��������立�Ӧ�Ļ�ѧ����ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(2)�������֪���������Ķ�����������Խ�̿��Ӧ���ɵ����Ͷ�����̼����Ӧ�Ļ�ѧ����ʽΪ2NO2+2C=N2+2CO2���ɷ���ʽ��֪������1mol��������Ӧת��8mol���ӣ��ʴ�Ϊ��8��
(3)���������֪����������������������һ���������������������������Һ��Ӧ��һ����������������������Һ��Ӧ����![]() ����1.4ʱ��NO2��OH��Ӧ����NO
����1.4ʱ��NO2��OH��Ӧ����NO
��O3��NO��Ӧ�Ļ�ѧ����ʽΪNO+O3=NO2+O2��NO��NO2������������Һ��Ӧ�Ļ�ѧ����ʽΪNO+ NO2+2OH-=2NO2-+ H2O����ͼ��֪����������һ�����������ʵ�����Ϊ1.4ʱNOxȥ��Ч����ã���һ�����������ʵ���Ϊx��![]() Ϊa������������ʵ���Ϊax���ɷ���ʽ�Ϳ�֪����������һ�����������ʵ�����Ϊ1.2�ɵ�ax=1.4(x-ax)�� ���x��0.6���ʴ�Ϊ��0.6��
Ϊa������������ʵ���Ϊax���ɷ���ʽ�Ϳ�֪����������һ�����������ʵ�����Ϊ1.2�ɵ�ax=1.4(x-ax)�� ���x��0.6���ʴ�Ϊ��0.6��
(4)����֪��Ӧ���α��Ϊ�٢����ɸ�˹���ɿ�֪��-����2�ɵ�![]() �����H=-905.5kJ/mol-(+180 kJ/mol)��2=-1265.5 kJ/mol���ʴ�Ϊ��1265.5��
�����H=-905.5kJ/mol-(+180 kJ/mol)��2=-1265.5 kJ/mol���ʴ�Ϊ��1265.5��

����Ŀ����Դ��ȱ������������ٵ��ش����⣬�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����֪��CO��H2��CH3OH��g����ȼ���ȷֱ�Ϊ283kJ/mol��285.8kJ/mol��768kJ/mol����ҵ��һ�����úϳ����������з�Ӧ�ϳɼ״���CO��g��+ 2H2��g��![]() CH3OH��g����
CH3OH��g����
����ɸ��Ȼ�ѧ����ʽ��CO��g��+ 2H2��g��![]() CH3OH��g����H=______ kJ/mol��
CH3OH��g����H=______ kJ/mol��
��ij�¶��£���2mol CO��6mol H2����2L���ܱ������У��ﵽƽ�⣬���c��H2��= 2.2molL��1����CO��ת����Ϊ______��
��2��T1��ʱ���˷�Ӧ��ƽ�ⳣ��ΪK��T1��= 50�����¶��£���һ��2L���ܱ������м���һ����CO��H2����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
���� | H2 | CO | CH3OH(g) |
Ũ��/��molL��1�� | 0.2 | 0.2 | 0.4 |
�ٱȽϴ�ʱ�����淴Ӧ���ʵĴ�С��v��____v��ֵ�����������������=������
���������������䣬��T2�淴Ӧl0min���ִﵽƽ�⣬���n��H2��= 0.3mol���ԱȽϣ��¶�T1___T2�����������=����������ͬ��T2��ʱ�÷�Ӧ��ƽ�ⳣ��K��T2��______50��
����������������ʱ��ֻ�ı䷴Ӧ��ijһ������������˵����ȷ����______��
a�����ﵽ��ƽ��ʱc��CO��= 0.3mo1/L��ƽ��һ�������ƶ�
b���������������С��ԭ����һ�룬�ﵽ��ƽ��ʱ��0.2mol/L��c��CO����0.4mol/L
c������������ͬʱ����0.4mol CO��0.8mol CH3OH��g����ƽ�ⲻ�ƶ�
d�����������м���0.8mol CH3OH��g�����ﵽ��ƽ��ʱ��CO�������������