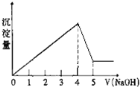
��Ŀ����
����Ŀ��ʵ����̽��SO2��Fe(NO3)3��Һ��Ӧ��ԭ����װ������ͼ��ʵ����Yװ�ò�����ɫ����������˵������ȷ����
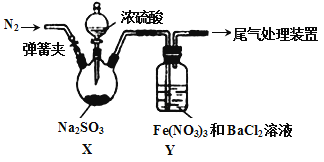
A. �μ�Ũ����֮ǰӦ���еIJ����Ǵ��ɼУ�ͨ��һ��ʱ��N2
B. Y�в����İ�ɫ������BaSO4��BaSO3
C. ������ɫ������ԭ�������������������SO2��NO3- ��Ӧ������SO42-
D. ����Fe(NO3)3����FeCl3��Y��Ҳ�ܲ�����ɫ������˵��Fe3+Ҳ�ܽ�SO2����
���𰸡�B
��������A.ͨ��һ��ʱ��N2����Ϊ���ų�������O2�ĸ��ţ���A��ȷ��B.����NO3-�����������¾���ǿ�����ԣ��ܽ�SO32 -����ΪSO42 -������Y�в����İ�ɫ������BaSO4����B����ȷ��ͬ��C.��ȷ��D. ����Fe(NO3)3����FeCl3��Y��Ҳ�ܲ�����ɫ�������ҳ���ΪBaSO4��˵��Fe3+Ҳ�ܽ�SO2������D��ȷ���ۺ����Ϸ����������Ϊ��B��

����Ŀ��![]() �ڹ�ҵ��ũҵ�ȷ����й㷺��Ӧ�ã���ҵ�Ͽ��ɸ������̿���Ҫ�ɷ�Ϊ
�ڹ�ҵ��ũҵ�ȷ����й㷺��Ӧ�ã���ҵ�Ͽ��ɸ������̿���Ҫ�ɷ�Ϊ![]() ������
������![]() �����ʣ��Ʊ������ֹ����������£�
�����ʣ��Ʊ������ֹ����������£�
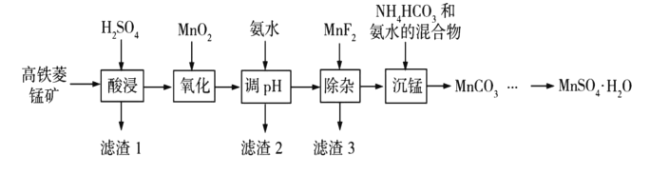
��ؽ������������������������![]() �������ʼ������
�������ʼ������![]() ������Ũ��Ϊ
������Ũ��Ϊ![]() ���㣩��
���㣩��
�������� |
|
|
|
|
|
��ʼ������pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 |
������ȫ��pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 |
��1����������ʱ������Ӧ�����ӷ���ʽΪ___________��
��2������pH����Χ��5~6���õ�����2����Ҫ�ɷֳ�![]() ���___________��
���___________��
��3�������ӡ������м���![]() ��Ŀ����___________��
��Ŀ����___________��
��4�������̡������з�����Ӧ�Ļ�ѧ����ʽΪ___________��
��5��![]() ��ˮ�е��ܽ�����¶ȵĹ�ϵ��ͼ��ʾ����
��ˮ�е��ܽ�����¶ȵĹ�ϵ��ͼ��ʾ����![]() ��ýϴ�����
��ýϴ�����![]() ����ķ����ǣ���
����ķ����ǣ���![]() ����������ϡ���ᣬ�����¶���80��~90��֮�������ᾧ��__________����������ƣ����õ�
����������ϡ���ᣬ�����¶���80��~90��֮�������ᾧ��__________����������ƣ����õ�![]() ���壬ϴ�ӡ���ɡ�����ͨ�����ü�ѹ��ɵ�ԭ����__________��
���壬ϴ�ӡ���ɡ�����ͨ�����ü�ѹ��ɵ�ԭ����__________��
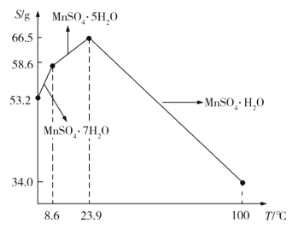
��6����֪��![]() �������£�����Һ��
�������£�����Һ��![]() ����ʹ��Һ�е�
����ʹ��Һ�е�![]() �����������ҺpH��ΧΪ______________________��
�����������ҺpH��ΧΪ______________________��
����Ŀ����Դ��ȱ������������ٵ��ش����⣬�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����֪��CO��H2��CH3OH��g����ȼ���ȷֱ�Ϊ283kJ/mol��285.8kJ/mol��768kJ/mol����ҵ��һ�����úϳ����������з�Ӧ�ϳɼ״���CO��g��+ 2H2��g��![]() CH3OH��g����
CH3OH��g����
����ɸ��Ȼ�ѧ����ʽ��CO��g��+ 2H2��g��![]() CH3OH��g����H=______ kJ/mol��
CH3OH��g����H=______ kJ/mol��
��ij�¶��£���2mol CO��6mol H2����2L���ܱ������У��ﵽƽ�⣬���c��H2��= 2.2molL��1����CO��ת����Ϊ______��
��2��T1��ʱ���˷�Ӧ��ƽ�ⳣ��ΪK��T1��= 50�����¶��£���һ��2L���ܱ������м���һ����CO��H2����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
���� | H2 | CO | CH3OH(g) |
Ũ��/��molL��1�� | 0.2 | 0.2 | 0.4 |
�ٱȽϴ�ʱ�����淴Ӧ���ʵĴ�С��v��____v��ֵ�����������������=������
���������������䣬��T2�淴Ӧl0min���ִﵽƽ�⣬���n��H2��= 0.3mol���ԱȽϣ��¶�T1___T2�����������=����������ͬ��T2��ʱ�÷�Ӧ��ƽ�ⳣ��K��T2��______50��
����������������ʱ��ֻ�ı䷴Ӧ��ijһ������������˵����ȷ����______��
a�����ﵽ��ƽ��ʱc��CO��= 0.3mo1/L��ƽ��һ�������ƶ�
b���������������С��ԭ����һ�룬�ﵽ��ƽ��ʱ��0.2mol/L��c��CO����0.4mol/L
c������������ͬʱ����0.4mol CO��0.8mol CH3OH��g����ƽ�ⲻ�ƶ�
d�����������м���0.8mol CH3OH��g�����ﵽ��ƽ��ʱ��CO�������������