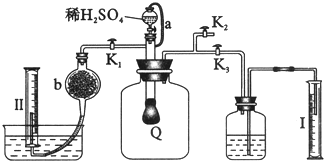
题目内容
6.下列过程都与热量变化有关,其中表述不正确的是( )| A. | CO(g)的燃烧热是283.0kJ/mol,则表示CO(g)燃烧反应的热化学方程式为CO(g)+$\frac{1}{2}$O2(g)═CO2(g);△H=-283.0kJ/mol | |
| B. | 稀盐酸和稀氢氧化钠溶液反应的中和热为57.3kJ/mol,则表示稀硫酸与稀氢氧化钾溶液发生反应的热化学方程式为$\frac{1}{2}$H2SO4(l)+KOH(aq)═$\frac{1}{2}$K2SO4(aq)+H2O(l);△H=-57.3kJ/mol | |
| C. | 铝热反应是放热反应,但需要足够的热量才能使反应发生 | |
| D. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H>0 |
分析 A.根据燃烧热的概念判断;
B.根据中和热的含义:稀的强酸和强碱溶液反应生成1mol水所产生的能量结合物质的聚集状态来回答;
C.铝热反应需要在高温下发生;
D.△H-T△S>0的反应不能够自发进行;
解答 解:A.燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,表示CO(g)燃烧热的热化学方程式为CO(g)+$\frac{1}{2}$O2(g)=CO2(g);△H=-283.0KJ/mol,故A正确;
B.稀硫酸与稀氢氧化钾溶液发生反应的热化学方程式为$\frac{1}{2}$H2SO4(aq)+KOH(aq)═$\frac{1}{2}$K2SO4(aq)+H2O(l);△H=-57.3kJ/mol,故B错误;
C.铝热反应是放热反应,但是铝热反应需要在高温下发生,故C正确;
D.该反应的△S>0,室温下不能自发进行,说明△H-T△S>0,所以该反应的△H>0,故D正确;
故选B.
点评 本题考查学生对燃烧热概念和中和热的理解、自发的判断等,难度不大.

练习册系列答案
相关题目
17.“纳米材料”是粒子直径为1nm~100nm的材料,纳米碳就是其中的一种.某研究所将纳米碳均匀的分散到蒸馏水中,得到的物质:①是溶液 ②是胶体 ③具有丁达尔现象 ④具有吸附性 ⑤浊液.其中正确的是( )
| A. | ②③④ | B. | ②③⑤ | C. | ①④⑥ | D. | ①③④⑥ |
14.已知1mol燃料完全燃烧的数据分别为:
使用上述燃料.最能体现“低碳经济”理念的是( )
| 燃料 | 一氧化碳 | 甲烷 | 异辛烷(C8H18) | 乙醇 |
| △H | -283.0kJ•mol-1 | -891.0kJ•mol-1 | -5461.0kJ•mol-1 | -1366.8kJ•mol-1 |
| A. | 一氧化碳 | B. | 甲烷 | C. | 异辛烷 | D. | 乙醇 |
1.用惰性电极电解CuSO4溶液一段时间后,停止电解,向所得溶液中加入0.1mol Cu(OH)2,恰好反应时溶液浓度恢复至电解前.关于该电解过程的说法不正确的是( )
| A. | 生成Cu的物质的量是0.1mol | B. | 随着电解的进行溶液的c(H+)增大 | ||
| C. | 转移电子的物质的量是0.2mol | D. | 阳极反应式是4OH--4e-═2H2O+O2↑ |
11.常用两种方法制备氯化物:①金属与氯气直接化合;②金属与盐酸反应.上述两种方法都可制得的氯化物是( )
| A. | CuCl2 | B. | ZnCl2 | C. | FeCl3 | D. | AlCl3 |
18.下列反应中,属于加成反应的是( )
| A. | C2H5OH $→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O | |
| B. | CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O | |
| C. | CH3-CH=CH2+Br2→CH3-CHBr-CH2Br | |
| D. | 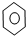 +Br2 $\stackrel{Fe}{→}$ +Br2 $\stackrel{Fe}{→}$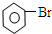 +HBr +HBr |
15.下列关于摩尔的说法中,正确的是( )
| A. | 是物质的量 | B. | 是一个物理量 | ||
| C. | 是一种物理量的单位 | D. | 是摩尔质量 |
16.下列说法正确的是( )
| A. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| B. | 对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 | |
| C. | 在同一条件下,不同物质有不同的焓值,其体系的混乱程度越大,焓值越大 | |
| D. | AgCl在浓度相同的MgCl2溶液和KCl溶液中的溶解度相同 |