题目内容
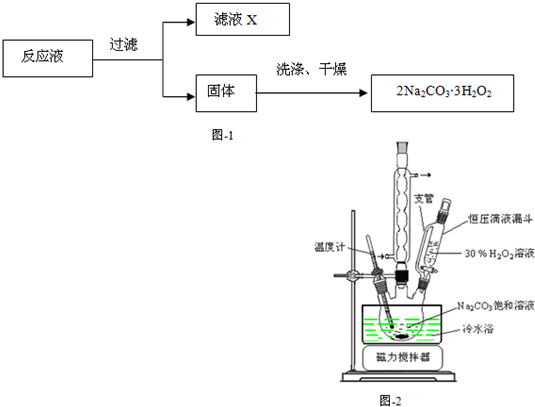
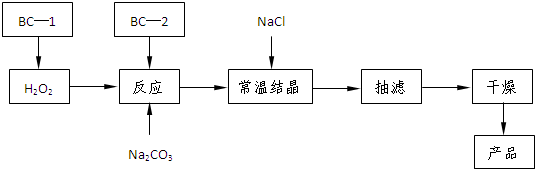
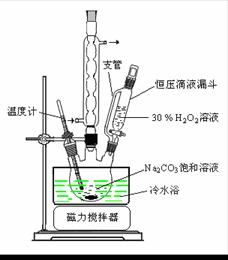
过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:
 已知:主反应 2Na2CO3 (aq) + 3H2O2 (aq)
已知:主反应 2Na2CO3 (aq) + 3H2O2 (aq) ![]() 2Na2CO3·3H2O2 (s) ΔH < 0
2Na2CO3·3H2O2 (s) ΔH < 0
副反应 2H2O2 = 2H2O + O2↑
滴定反应 6KMnO4 + 5(2Na2CO3·3H2O2) +19H2SO4 =
3K2SO4 + 6MnSO4 +10Na2SO4 + 10CO2 ↑ + 15O2↑ + 34H2O
50 °C时 2Na2CO3·3H2O2 (s) 开始分解
请回答下列问题:
(1)图中支管的作用是 。
(2)步骤①的关键是控制温度,其措施有 、 和 。
(3)在滤液X中加入适量NaCl固体或无水乙醇, 均可析出过碳酸钠,原因是 。
(4)步骤③中选用无水乙醇洗涤产品的目的是 。
(5)下列物质中,会引起过碳酸钠分解的有 。
A.Fe2O3 B.CuO
C.Na2SiO3 D.MgSO4
(6)准确称取0.2000 g 过碳酸钠于250 mL 锥形瓶中,加50 mL 蒸馏水溶解,再加50 mL 2.0 mol·L-1 H2SO4,用2.000×10-2 mol·L-1 KMnO4 标准溶液滴定至终点时消耗30.00 mL,则产品中H2O2的质量分数为 。
(1)平衡压强 (2分)
(2)冷水浴 磁力搅拌 缓慢滴加H2O2溶液 (3分)
(3)降低产品的溶解度(盐析作用或醇析作用) (2分)
(4)洗去水份,利于干燥 (2分,其它合理答案均给分)
(5)AB (2分)
(6)0.2550 (或 25.50 %) (3分)

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案| A、实验室制备过碳酸钠时可釆用冷水浴控制反应温度 | B、过碳酸钠水溶液呈碱性,可用作漂洗剂和消毒杀菌剂 | C、过碳酸钠应密封保存,放置于冷暗处 | D、过碳酸钠可使酸性高锰酸钾溶液褪色,并放出一种无色气体 |



 已知:主反应 2Na2CO3 (aq)+3H2O2 (aq)
已知:主反应 2Na2CO3 (aq)+3H2O2 (aq)  2Na2CO3?3H2O2 (s)
2Na2CO3?3H2O2 (s)