题目内容
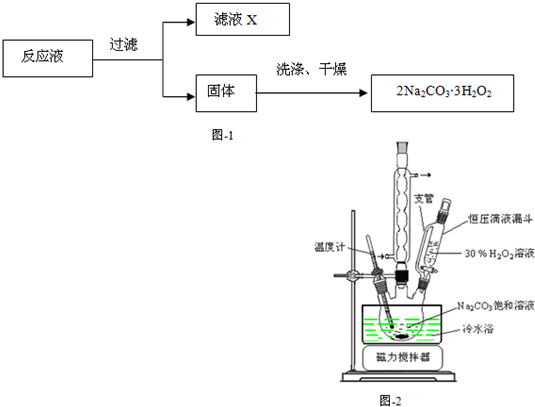
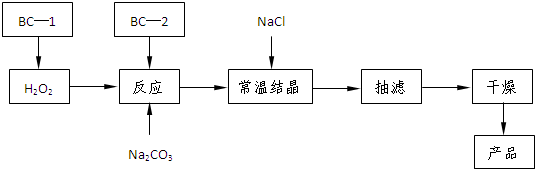
过碳酸钠(2Na2CO3?3H2O2)俗称固体双氧水,是一种很好的消毒剂和供氧剂(有活性氧存在),外观为白色自由流动颗粒,其制备流程如下图所示.图中BC-1、BC-2均为稳定剂,其中BC-1是由异丙醇和三乙醇胺按一定比例混合而成.过碳酸钠简易制备工艺路线
(1)制备过程中加入BC-1的目的是 .
(2)结晶过程中加入氯化钠、搅拌,作用是 .
(3)洗涤抽滤产品,合适的洗涤试剂是 (填选项编号).
A.饱和NaCl溶液 B.水 C.异丙醇 D.碳酸钠饱和溶液
(4)写出制备过碳酸钠的方程式: .
(5)由实验测定反应温度对产物的影响如下表:
根据上表数据,你认为反应最佳的温度选择的范围是 .

(1)制备过程中加入BC-1的目的是
(2)结晶过程中加入氯化钠、搅拌,作用是
(3)洗涤抽滤产品,合适的洗涤试剂是
A.饱和NaCl溶液 B.水 C.异丙醇 D.碳酸钠饱和溶液
(4)写出制备过碳酸钠的方程式:
(5)由实验测定反应温度对产物的影响如下表:
| T/°C | 活性氧百分含量 | 产率 |
| 5~10 | 13.94 | 85.49 |
| 10~15 | 14.02 | 85.78 |
| 15~20 | 15.05 | 88.38 |
| 20~25 | 14.46 | 83.01 |
分析:(1)双氧水易分解,根据双氧水的性质分析;
(2)抑制过碳酸钠溶解;
(3)根据相似相溶原理分析;
(4)根据反应物和生成物写出反应方程式;
(5)根据温度和产率的关系判断.
(2)抑制过碳酸钠溶解;
(3)根据相似相溶原理分析;
(4)根据反应物和生成物写出反应方程式;
(5)根据温度和产率的关系判断.
解答:解:(1)双氧水易分解,BC-1为稳定剂,加入BC-1能增强双氧水的稳定性,从而抑制其分解,故答案为:增强H2O2的稳定性,防止其分解;
(2)结晶过程中加入氯化钠、搅拌,能降低过碳酸钠的溶解度,有利于过碳酸钠析出,
故答案为:降低过碳酸钠的溶解度,有利于过碳酸钠析出;
(3)根据相似相溶原理知,过碳酸钠难溶于有机溶剂,且易分离,故选C;
(4)碳酸钠和双氧水反应生成过碳酸钙,反应方程式为:2Na2CO3+3H2O2=2Na2CO3?3H2O2,故答案为:2Na2CO3+3H2O2=2Na2CO3?3H2O2;
(5)根据表格中温度和产率的关系知,15℃~20℃时,其产率最高,故答案为:15℃~20℃.
(2)结晶过程中加入氯化钠、搅拌,能降低过碳酸钠的溶解度,有利于过碳酸钠析出,
故答案为:降低过碳酸钠的溶解度,有利于过碳酸钠析出;
(3)根据相似相溶原理知,过碳酸钠难溶于有机溶剂,且易分离,故选C;
(4)碳酸钠和双氧水反应生成过碳酸钙,反应方程式为:2Na2CO3+3H2O2=2Na2CO3?3H2O2,故答案为:2Na2CO3+3H2O2=2Na2CO3?3H2O2;
(5)根据表格中温度和产率的关系知,15℃~20℃时,其产率最高,故答案为:15℃~20℃.
点评:本题考查实验方案设计,根据物质的性质来分析解答,难度不大.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
过碳酸钠(2Na2CO3?3H2O2)在生产和生活领域应用广泛,其制备反应为:2Na2CO3(aq)+3H2O2?2Na2CO3?3H2O2(s)△H<0.过碳酸钠具有Na2CO3和H2O2的双重性质,在50℃时分解为碳酸钠和过氧化氢.下列有关说法错误的是( )
| A、实验室制备过碳酸钠时可釆用冷水浴控制反应温度 | B、过碳酸钠水溶液呈碱性,可用作漂洗剂和消毒杀菌剂 | C、过碳酸钠应密封保存,放置于冷暗处 | D、过碳酸钠可使酸性高锰酸钾溶液褪色,并放出一种无色气体 |



 已知:主反应 2Na2CO3 (aq)+3H2O2 (aq)
已知:主反应 2Na2CO3 (aq)+3H2O2 (aq)  2Na2CO3?3H2O2 (s)
2Na2CO3?3H2O2 (s)