题目内容
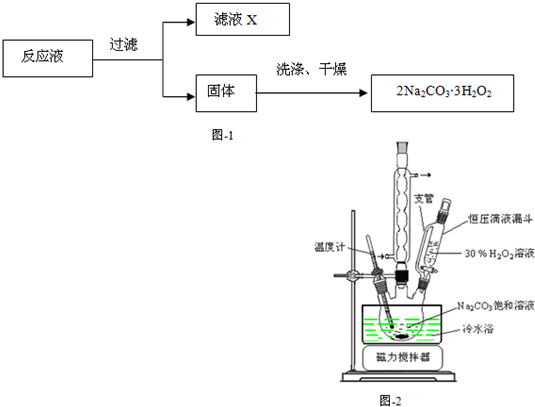
过碳酸钠(2Na2CO3?3H2O2)在生产和生活领域应用广泛,其制备反应为:2Na2CO3(aq)+3H2O2?2Na2CO3?3H2O2(s)△H<0.过碳酸钠具有Na2CO3和H2O2的双重性质,在50℃时分解为碳酸钠和过氧化氢.下列有关说法错误的是( )
| A、实验室制备过碳酸钠时可釆用冷水浴控制反应温度 | B、过碳酸钠水溶液呈碱性,可用作漂洗剂和消毒杀菌剂 | C、过碳酸钠应密封保存,放置于冷暗处 | D、过碳酸钠可使酸性高锰酸钾溶液褪色,并放出一种无色气体 |
分析:由题给信息可知过碳酸钠具有Na2CO3和H2O2的双重性质,则应具有碱性、强氧化性,可用于杀菌消毒,在50℃时分解为碳酸钠和过氧化氢,则应密封保存,结合碳酸钠和过氧化氢的性质解答该题.
解答:解:A.在50℃时分解为碳酸钠和过氧化氢,则制备过碳酸钠时可釆用冷水浴控制反应温度,不能使反应温度过高,故A正确;
B.碳酸钠具有Na2CO3和H2O2的双重性质,其中碳酸钠水解呈碱性,过氧化氢具有强氧化性,可用于漂洗剂和消毒杀菌剂,故B正确;
C.过碳酸钠应密封保存,放置于冷暗处,可防止温度过高而分解,故C正确;
D.过碳酸钠可使酸性高锰酸钾溶液褪色,其中碳酸钠与酸反应生成二氧化碳气体,过氧化氢与高锰酸钾发生氧化还原反应生成氧气,则生成两种气体,故D错误.
故选D.
B.碳酸钠具有Na2CO3和H2O2的双重性质,其中碳酸钠水解呈碱性,过氧化氢具有强氧化性,可用于漂洗剂和消毒杀菌剂,故B正确;
C.过碳酸钠应密封保存,放置于冷暗处,可防止温度过高而分解,故C正确;
D.过碳酸钠可使酸性高锰酸钾溶液褪色,其中碳酸钠与酸反应生成二氧化碳气体,过氧化氢与高锰酸钾发生氧化还原反应生成氧气,则生成两种气体,故D错误.
故选D.
点评:本题主要考查了碳酸盐及过氧化氢的性质,侧重于学生的分析能力和自学能力的考查,为高频考点,注意把握过氧化氢和碳酸钠的性质,然后利用它们的性质来正确的解答该题,难度不大.

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目



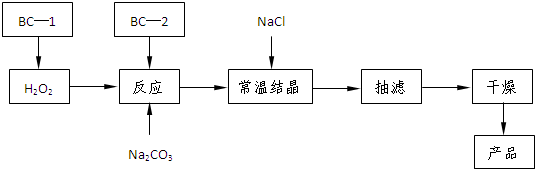
 已知:主反应 2Na2CO3 (aq)+3H2O2 (aq)
已知:主反应 2Na2CO3 (aq)+3H2O2 (aq)  2Na2CO3?3H2O2 (s)
2Na2CO3?3H2O2 (s)