题目内容
【题目】自然界存在丰富的碳、氮、氧、铝、钾、铁、碘等元素,按要求回答下列问题:
(1)常温,羰基铁[Fe(CO)x)]是红棕色液体,不溶于水,溶于乙醇、乙醚等,据此判断羰基铁晶体属于________________(填晶体类型),羰基铁的配体是________。已知:羰基铁的中心原子价电子数与配体提供电子数之和为18,则x=_________;98g羰基铁中含有的![]() 键数为______________个。
键数为______________个。
(2)亚铁离子具有强还原性,从电子排布的角度解释,其原因是__________
(3)BN晶体、AlN晶体结构相似,如图1,两者熔沸点较高的物质是______,原因是_________

(4)KIO3晶体是一种性能良好的光学材料,其晶胞为立方体,晶胞中K、I、O分别处于顶点、体心、面心位置,如图2所示,如果KIO3密度为a g![]() cm-3,则K与O间的最短距离为___cm。
cm-3,则K与O间的最短距离为___cm。
【答案】分子晶体 CO 5 5NA Fe2+的3d轨道有6个电子,失去1个电子后3d轨道电子排布处于半充满稳定状态 BN晶体 二者都为原子晶体,B原子半径小于A1原子半径,氮硼键的键能比氮铝键的键能大 ![]()
![]()
【解析】
(1)分子晶体熔沸点较低,该晶体熔沸点较低,为分子晶体;配合物中配体提供孤电子对、中心原子提供空轨道,所以羰基铁的配体是CO;中心Fe的价电子数是8,每个配体提供的电子数是2,据此判断x值为5;每个Fe(CO)5中σ键个数为10个,98g羰基铁的物质的量=![]() ,则98g羰基铁中含有σ键物质的量为5mol;则98g羰基铁中含有的σ键数为5NA,故答案为:分子晶体;CO;5;5NA;
,则98g羰基铁中含有σ键物质的量为5mol;则98g羰基铁中含有的σ键数为5NA,故答案为:分子晶体;CO;5;5NA;
(2)Fe2+的3d轨道有6个电子,失去1个电子后3d轨道电子排布处于半充满稳定状态,所以亚铁离子具有还原性,故答案为:Fe2+的3d轨道有6个电子,失去1个电子后3d轨道电子排布处于半充满稳定状态;
(3)二者都是原子晶体,原子晶体熔沸点与其键能成正比,键能与键长成反比,B原子半径小于A1原子半径,氮硼键的键能比氮铝键的键能大,所以BN的熔沸点较高,故答案为:BN晶体;二者都为原子晶体,B原子半径小于A1原子半径,氮硼键的键能比氮铝键的键能大;
(4)K原子个数=8×1/8=1,I原子个数为1、O原子个数=6×1/2=3,晶胞棱长=![]() =
=![]()
![]() cm,K与O间的最短距离为面对角线长度的一半=
cm,K与O间的最短距离为面对角线长度的一半=![]()
![]() cm,故答案为:
cm,故答案为:![]()
![]() 。
。

【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1)NaClO2的化学名称为__________。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度323 K,NaClO2溶液浓度为5×10-3 mol/L。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c/(mol/L) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
①出NaClO2溶液脱硝过程中主要反应的离子方程式__________________________。增加压强,NO的转化率________________(填“提高”“不变”或“降低”)。
②着吸收反应的进行,吸收剂溶液的pH逐渐____________(填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______________反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是____________。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是______________。
②知下列反应:
SO2(g)+2OH-(aq) =SO32-(aq)+H2O(l) ΔH1
ClO-(aq)+SO32-(aq)=SO42-(aq)+Cl-(aq)ΔH2
CaSO4(s)=Ca2+(aq)+SO42-(aq) ΔH3
则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=______。
【题目】除去下列物质中的杂质( )![]() 括号内为杂质
括号内为杂质![]() ,所选用的试剂及操作方法均正确的一组是( )
,所选用的试剂及操作方法均正确的一组是( )
选项 | 待提纯的物质 | 选用的试剂 | 操作的方法 |
A |
| 水 | 溶解、过滤、结晶 |
B |
| 稀盐酸 | 溶解、过滤、洗涤、干燥 |
C |
| 氢氧化钠溶液 | 过滤 |
D |
| 氧气 | 点燃 |
A.AB.BC.CD.D
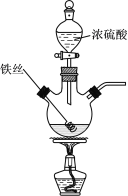
【题目】乙酸异戊酯是组成密蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:

相对分子质量 | 密度/(g·cm3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1 .0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
实验步骤:在A中加入4.4g异戊醇![]() 、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液洗涤;分出的产物再加入少量无水Na2SO4固体,静止片刻。过滤除去Na2SO4固体,讲行蒸馏纯化。收集140~143°C馏分,得到乙酸异戊酯3.9g。回答下列问题:
、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液洗涤;分出的产物再加入少量无水Na2SO4固体,静止片刻。过滤除去Na2SO4固体,讲行蒸馏纯化。收集140~143°C馏分,得到乙酸异戊酯3.9g。回答下列问题:
(1)实验中制备乙酸异戊酯的化学方程式为_________________。
(2)仪器B的名称是_______________,作用是____________。
(3)在洗涤操作中饱和碳酸氢钠溶液的主要作用是______________。
(4)实验中加入少量无水Na2SO4的目的是_________________________。
(5)实验中加过量乙酸的目的是___________________________。
(6)本实验的产率是_______________(填标号)。
a.30% b.40% c.50% d.60%
【题目】下表为元素周期表的局部X、Y、Z、W均为短周期元素,其原子序数之和为47:
X | |||||
Y | Z | W |
(1)X、Y、Z、W的元素符号依次为_______、________、_______、__________(以下所有问题均用元素符号回答);
(2)X和Y的化合物中的两种微粒均达到了8电子稳定结构,该化合物的电子式为_____;将该化合物的固体溶于足量W的气态氢化物水溶液中,生成两种盐该反应的离子方程式为______________,生成的两种盐的电子式为__________、_____________;
(3)Z的氧化物为_________(填酸性、碱性、两性、不成盐)氧化物,Y、Z、W的最高价氧化物对应的水化物两两之间反应的化学方程式为:![]() __________________________________;
__________________________________;![]() ___________________________;
___________________________;![]() ________________________.
________________________.