题目内容
【题目】已知:2Fe+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑+6H2O。某学习小组对铁丝(含杂质碳)与浓硫酸反应后的产物进行探究。
Fe2(SO4)3+3SO2↑+6H2O。某学习小组对铁丝(含杂质碳)与浓硫酸反应后的产物进行探究。
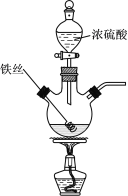
Ⅰ.溶液探究
(1)将反应后的溶液稀释,取稀释液,滴加NaOH溶液,观察到___现象时,证明有Fe3+存在。为进一步判断溶液中是否存在Fe2+,可另取稀释液少许,滴加___(选填编号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.KMnO4酸性溶液
(2)为判断反应停止后硫酸是否有剩余,制定的实验方案为:测定稀释液的pH。请对此实验设计进行评价。____。
Ⅱ.气体探究
(3)将产生的气体依次通过品红溶液和澄清石灰水,观察到:品红溶液褪色、澄清石灰水变浑浊。是否___(填写“是”或“否”)能据此判断除SO2外,反应后气体中还含有CO2?请说明理由___。
最后逸出的气体具有可燃性,推测该气体为H2,理由是___(用离子方程式表示)。
(4)收集混合气体336mL(已折算成标准状况),通入足量的氯水中,发生反应:SO2+Cl2+2H2O=H2SO4+2HCl。滴加足量BaCl2溶液,生成的沉淀经过滤、洗涤、干燥、称量,测得质量为2.330g。则混合气体中SO2的体积分数为___。(精确至小数点后第二位)
(5)将上述混合气体直接通入BaCl2溶液,未见明显现象,放置一段时间后发现有少许浑浊,分析其中的原因___。
【答案】红褐色沉淀 d 由于Fe3+水解显酸性,所以不能仅通过溶液显酸性就判断反应后硫酸是否有剩余(或:如果测得溶液的酸性较强,可以判断硫酸有剩余) 否 由于有SO2存在,SO2也能使澄清石灰水变浑浊,所以无法判断是否含有CO2 Fe+2H+=Fe2++H2↑ 0.67 开始未见明显现象是因为SO2不能与BaCl2反应,一段时间后空气中的O2将H2SO3氧化成为H2SO4,从而与BaCl2反应生成BaSO4沉淀
【解析】
(1)2Fe+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑+6H2O,将反应后的溶液稀释,取稀释液,滴加NaOH溶液,铁离子与氢氧化钠反应生成红褐色的氢氧化铁沉淀;在Fe3+存在时检验Fe2+,结合亚铁离子的性质分析判断选择的试剂;
Fe2(SO4)3+3SO2↑+6H2O,将反应后的溶液稀释,取稀释液,滴加NaOH溶液,铁离子与氢氧化钠反应生成红褐色的氢氧化铁沉淀;在Fe3+存在时检验Fe2+,结合亚铁离子的性质分析判断选择的试剂;
(2)铁离子水解后的溶液也显酸性,但酸性较弱,据此分析评价;
(3)根据SO2也能使澄清石灰水变浑浊分析判断;最后逸出的气体具有可燃性,该气体只能为H2,因为随着反应的进行,硫酸的浓度逐渐减小;
(4)首先计算标准状况下,336mL混合气体的物质的量,再根据生成的硫酸钡的质量计算二氧化硫的物质的量,最后计算混合气体中SO2的体积分数;
(5)SO2与BaCl2不反应,结合二氧化硫检验较强的还原性分析解答。
(1)2Fe+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑+6H2O,将反应后的溶液稀释,取稀释液,滴加NaOH溶液,铁离子与氢氧化钠反应生成红褐色的氢氧化铁沉淀,证明有Fe3+存在。为进一步判断溶液中是否存在Fe2+,可另取稀释液少许,因为溶液中含有Fe3+,可以滴加KMnO4酸性溶液,若溶液的紫红色褪色,即可以证明溶液中含有Fe2+,故答案为:红褐色沉淀;d;
Fe2(SO4)3+3SO2↑+6H2O,将反应后的溶液稀释,取稀释液,滴加NaOH溶液,铁离子与氢氧化钠反应生成红褐色的氢氧化铁沉淀,证明有Fe3+存在。为进一步判断溶液中是否存在Fe2+,可另取稀释液少许,因为溶液中含有Fe3+,可以滴加KMnO4酸性溶液,若溶液的紫红色褪色,即可以证明溶液中含有Fe2+,故答案为:红褐色沉淀;d;
(2)测定稀释液的pH,若溶液显酸性不能说明反应后硫酸是否有剩余,因为铁离子水解后的溶液也显酸性,若溶液的酸性较强,可以判断硫酸有剩余,因为铁离子水解后的溶液的酸性较弱,故答案为:由于Fe3+水解显酸性,所以不能仅通过溶液显酸性判断反应后硫酸是否有剩余(或如果测得溶液的酸性较强,可以判断硫酸有剩余);
(3)将产生的气体依次通过品红溶液和澄清石灰水,观察到:品红溶液褪色、澄清石灰水变浑浊。不能据此判断除SO2外,反应后气体中还含有CO2,因为混合气体中存在SO2气体,SO2也能使澄清石灰水变浑浊;最后逸出的气体具有可燃性,说明该气体为H2,因为随着反应的进行,硫酸的浓度逐渐减小,稀硫酸能够与铁反应生成氢气,Fe+2H+=Fe2++H2↑,故答案为:否;由于有SO2存在,SO2也能使澄清石灰水变浑浊,所以无法判断是否含有CO2;Fe+2H+→Fe2++H2↑;
(4)标准状况下,336mL混合气体的物质的量为![]() =0.015mol,生成的硫酸钡的物质的量=
=0.015mol,生成的硫酸钡的物质的量=![]() =0.01mol,说明二氧化硫的物质的量为0.01mol,因此混合气体中SO2的体积分数为
=0.01mol,说明二氧化硫的物质的量为0.01mol,因此混合气体中SO2的体积分数为![]() ×100%=0.67,故答案为:0.67;
×100%=0.67,故答案为:0.67;
(5)将上述混合气体直接通入BaCl2溶液,SO2与BaCl2不反应,因此未见明显现象,放置一段时间后,溶液中的亚硫酸被空气中的氧气氧化生成硫酸,硫酸与氯化钡反应生成硫酸钡沉淀,故答案为:开始未见明显现象是因为SO2不能与BaCl2反应,一段时间后空气中的O2将H2SO3氧化成为H2SO4,从而与BaCl2反应生成BaSO4沉淀。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案