题目内容
【题目】(1)已知:As(s)+![]() H2(g)+2O2(g)===H3AsO4(s) ΔH1
H2(g)+2O2(g)===H3AsO4(s) ΔH1
H2(g)+![]() O2(g)===H2O(l) ΔH2
O2(g)===H2O(l) ΔH2
2As(s)+![]() O2(g)===As2O5(s) ΔH3
O2(g)===As2O5(s) ΔH3
则反应As2O5(s)+3H2O(l)===2H3AsO4(s)的ΔH=____________________。
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为__________________、_____________,制得等量H2所需能量较少的是________。
(3)N2与H2反应生成NH3的过程中能量变化曲线如图所示。若在一个固定容积的密闭容器中充入1 mol N2和3 mol H2,使反应N2+3H2![]() 2NH3达到平衡,测得反应放出热量为Q1。填写下列空白:
2NH3达到平衡,测得反应放出热量为Q1。填写下列空白:
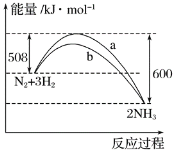
①Q1____________________92 kJ。
②b曲线是______________时的能量变化曲线。
③上述条件下达到平衡时H2的转化率为_______________。
④在温度体积一定的条件下,若通入2 mol N2和6 mol H2反应后放 出的热量为Q2 kJ,则2Q1与Q2的关系为____________________。
【答案】2ΔH1-3ΔH2-ΔH3 H2O(l)=H2(g)+ ![]() O2(g) △H=+286 kJ/mol H2S (g)=H2(g)+S(s) △H=+20 kJ/mol 系统II < 加催化剂
O2(g) △H=+286 kJ/mol H2S (g)=H2(g)+S(s) △H=+20 kJ/mol 系统II < 加催化剂 ![]() Q2>2Q1
Q2>2Q1
【解析】
(1)已知:①As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
②H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
③2As(s)+![]() O2(g)=As2O5(s) ΔH3
O2(g)=As2O5(s) ΔH3
根据盖斯定律,由①×2-②×3-③可得反应As2O5(s)+3H2O(l)=2H3AsO4(s) ΔH=2ΔH1-3ΔH2-ΔH3;
(2)①H2SO4(aq)=SO2(g)+H2O(l)+![]() O2(g) △H1=+327 kJ/mol
O2(g) △H1=+327 kJ/mol
②SO2(g)+I2(s)+ 2H2O(l)=2HI(aq)+ H2SO4(aq) △H2=-151 kJ/mol
③2HI(aq)= H2 (g)+ I2(s) △H3=+110 kJ/mol
④H2S(g)+ H2SO4(aq)=S(s)+SO2(g)+ 2H2O(l) △H4=+61 kJ/mol
①+②+③,整理可得系统(I)的热化学方程式H2O(l)=H2(g)+ ![]() O2(g) △H=+286 kJ/mol;
O2(g) △H=+286 kJ/mol;
②+③+④,整理可得系统(II)的热化学方程式H2S (g)=H2(g)+S(s) △H=+20 kJ/mol。
根据系统I、系统II的热化学方程式可知:每反应产生1 mol氢气,后者吸收的热量比前者少,所以制取等量的H2所需能量较少的是系统II;
(3)①由图可知反应的热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=508 kJmol-1-600 kJmol-1=-92kJmol-1,N2与H2反应生成NH3的反应为可逆反应,反应为不能完全转化为生成物,即1mol N2和3mol H2不能完全反应生成1molNH3,则反应放出的热量值Q1<92 kJ;
②加催化剂降低反应的活化能,所以图中b曲线代表加入了催化剂;
③设转化的氢气为xmol,
N2(g)+3H2(g)=2NH3(g)△H=-92kJmol-1
3mol 92kJ
xmol Q1kJ
则x=![]() mol
mol
所以 达平衡时H2的转化率为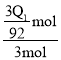 =
=![]() ;
;
④向密闭容器中通入1mol N2和3mol H2,不可能完全转化,所以达到平衡时放出热量Q1kJ;另一容积相同的密闭容器中通入2mol N2和6mol H2,达到平衡时若与原平衡相同,则放出热量应该是2Q1kJ,通入2mol N2和6mol H2的压强比通入1mol N2和3mol H2的大了,平衡还会向正向移动,放出的热量还会增大,即Q2>2Q1。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案