题目内容
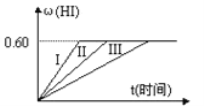
【题目】将1molI2(g)和2molH2置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)![]() 2HI(g);△H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线(II)所示
2HI(g);△H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线(II)所示
(1)达平衡时,I2(g)的物质的量浓度为____。
(2)若改变反应条件下,在甲条件下ω(HI)的变化如图曲线(I)所示,在乙条件下ω(HI)的变化如图曲线(III)所示。则甲条件可能是___(填入下列条件的序号。下同),乙条件可能是___。
①恒容条件下,升高温度 ②恒容条件下,降低温度 ③恒温条件下,缩小反应容器体积 ④恒温条件下,扩大反应容器体积 ⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入amolI2(g)、bmolH2和cmolHI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的应满足的关系是____(用含一个a、b、c的代数式表示)
【答案】0.05mol/L ③⑤ ④ 4a-2b+c=0
【解析】
(1)该反应是一个反应前后气体体积不变的化学反应,所以反应后混合气体的物质的量是3mol,同一容器中各种气体的体积分数等其物质的量分数,所以平衡时碘化氢的物质的量=3mol×0.6=1.8mol,则参加反应的n(I2)=0.5n(HI)=0.5×1.8 mol =0.9mol,剩余的n(I2)=1 mol 0.9 mol =0.1mol,所以平衡时c(I2)=![]() =0.05mol/L,
=0.05mol/L,
故答案为:0.05mol/L;
(2)在甲条件下w(HI)的变化如曲线(Ⅰ)所示,反应时间缩短,碘化氢的含量不变,说明该条件只增大了反应速率不影响平衡,增大压强(缩小反应容器体积)和加入催化剂对该反应平衡无影响,但都增大反应速率,缩短反应时间;
在乙条件下w(HI)的变化如曲线(Ⅲ)所示,反应时间变长,碘化氢的含量不变,说明反应速率减小,衡不移动,所以是减小压强(扩大容器体积),
故答案为:③⑤;④;
(3)若保持温度不变,在另一个相同的2L密闭容器中加入amolI2(g)、bmolH2(g)和cmolHI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.6,与原来的平衡是等效平衡,恒温恒容,前后气体体积不变化,按化学计量数转化到左边,满足与原来加入的反应物物质的量比例相等即可;
I2(g)+H2(g)2HI(g);
开始(mol):ab c
变化(mol):0.5c0.5cc
平衡(mol):a+0.5cb+0.5c0
则(a+0.5c):(b+0.5c)=1:2,
所以4a-2b+c=0,
故答案为:4a-2b+c=0

 名校课堂系列答案
名校课堂系列答案【题目】奥运五环代表着全世界五大洲的人民团结在一起。下列各项中的物质,能满足如图中阴影部分关系的是( )

① | ② | ③ | ④ | |
A | NaCl | K2SO4 | KCl | (NH4)2SO4 |
B | Na2SO4 | K2SO4 | KCl | NH4Cl |
C | NaCl | K2SO4 | KCl | NH4Cl |
D | Na2SO4 | K2SO4 | KCl | (NH4)2SO4 |
A.AB.BC.CD.D