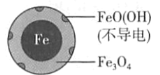
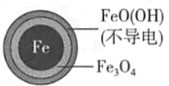
��Ŀ����
����Ŀ����ͼ����Уʵ���һ�ѧ�Լ�Ũ�����ǩ�ϵIJ������ݡ�����Ҫ 240mL 1 mol�� L-1 ��ϡ���ᡣ�ø�Ũ���������ˮ���ƣ��ɹ�ѡ�� �������У��� ��ͷ�ιܣ��ڲ����������ձ�������Ͳ�� ��ش��������⣺

��1������ϡ����ʱ����ȱ�ٵ�������________��д�������ƣ���
��2������������ʵ���Ũ��Ϊ__________ mol/L������Ũ��������ԼΪ_______mL��������Ũ������������ˮ��ϣ�������Һ�����ʵ���������_______49%������>�� ����<�� ������������
��3������ʱ,�������ˮ�����̶��ߣ������ȡ�Ĵ�ʩ��_________________
��4�����в����� H2SO4 �����ʵ���Ũ����ʲôӰ�죨ƫ�ߡ�ƫ�ͻ���Ӱ�죩��
��ת����Һ��δϴ���ձ���_________________ ��
����Ͳ��ȡҺ��ҩƷʱ���Ӷ�����_____________ ��
��δ����Һ��ȴ�Ͷ��ݣ�_____________ ��
��5�������ƹ����У����в�������ȷ���ǣ�����ţ� _____________��
A��ʹ������ƿǰ������Ƿ�©ˮ
B������ƿ������ˮϴ�������ô���Һ��ϴ
C����ȷ��ȡ�� 18.4mol��L��1 �����ᣬע����ʢ��100mLˮ��500mL������ƿ�У���ˮ���̶���
D������������ˮ������ȴ��������ת�Ƶ�����ƿ��
���𰸡�250mL ����ƿ 18.4 13.6 > �������� ƫ�� ƫ�� ƫ�� BC
��������
��1������240mL 1 mol�� L-1 ��ϡ���ᣬ����250mL����ƿ���ݣ�
��2������![]() ����Ũ�����Ũ�ȣ�����ϡ��ǰ����������ʵ������������ҪŨ��������������ϡ��ǰ���������������������������������
����Ũ�����Ũ�ȣ�����ϡ��ǰ����������ʵ������������ҪŨ��������������ϡ��ǰ���������������������������������
��3������ʱ���������ˮ�����̶��ߣ��������ơ�
��4������![]() ������
������
��5������������Һ�Ĺ淶�����жϡ�
��1������240mL 1 mol�� L-1 ��ϡ���ᣬ����250mL����ƿ���ݣ�ȱ�ٵ�������250mL ����ƿ��
��2��![]() =
=![]() 18.4 mol/L��
18.4 mol/L��
����Ũ��������ԼΪVmL��
18.4��V��1��250��V=13.6 mL��
��V mLŨ������V mLˮ��ϣ�������Һ�����ʵ���������=![]() ��������Һ�����ʵ���������>49%��
��������Һ�����ʵ���������>49%��
��3������ʱ���������ˮ�����̶��ߣ������ȡ�Ĵ�ʩ���������ơ�
��4����ת����Һ��δϴ���ձ�������ƫ�٣�H2SO4 �����ʵ���Ũ��ƫ�ͣ�
����Ͳ��ȡҺ��ҩƷʱ���Ӷ�����Ũ�������ƫ������ƫ�࣬H2SO4 �����ʵ���Ũ��ƫ�ߣ�
��δ����Һ��ȴ�Ͷ��ݣ���Һ���ƫС��H2SO4 �����ʵ���Ũ��ƫ�ߡ�
��5��A��ʹ������ƿǰ��Ҫ������Ƿ�©ˮ����A��ȷ��
B������ƿ������ˮϴ���������ô���Һ��ϴ����B����
C�����ձ���ϡ��Ũ���ᣬ����������ƿ��ϡ��Ũ���ᣬ��C����
D������������ˮ������ȴ�����£���ת�Ƶ�����ƿ�ж��ݣ���D��ȷ��
ѡBC��

����Ŀ�����������Fe��ȥ��ˮ���е������Σ�NO3-���ѳ�Ϊ�������о����ȵ�֮һ��
��1��Fe��ԭˮ����NO3-�ķ�Ӧԭ����ͼ��ʾ��

����������������____��
�������ĵ缫��Ӧʽ��____��
��2������������Ͷ��ˮ���У���24Сʱ�ⶨNO3-��ȥ���ʺ�pH��������£�
��ʼpH | pH=2.5 | pH=4.5 |
NO3-��ȥ���� | �ӽ�100% | ��50% |
24СʱpH | �ӽ����� | �ӽ����� |
��������������̬ |
|
|
pH=4.5ʱ��NO3-��ȥ���ʵ͡���ԭ����____��
��4�����������루2����ͬ����1Сʱ�ⶨNO3-��ȥ���ʺ�pH��������£�
��ʼpH | pH=2.5 | pH=4.5 |
NO3-��ȥ���� | Լ10% | Լ3% |
1СʱpH | �ӽ����� | �ӽ����� |
�루2�������ݶԱȣ����ͣ�2���г�ʼpH��ͬʱ��NO3-ȥ���ʺ���������������̬��ͬ��ԭ��____��
����Ŀ�����������Fe��ȥ��ˮ���е������Σ�NO3-���ѳ�Ϊ�������о����ȵ�֮һ��
��1��Fe��ԭˮ����NO3-�ķ�Ӧԭ����ͼ��ʾ��

����������������____��
�������ĵ缫��Ӧʽ��____��
��2������������Ͷ��ˮ���У���24Сʱ�ⶨNO3-��ȥ���ʺ�pH��������£�
��ʼpH | pH=2.5 | pH=4.5 |
NO3-��ȥ���� | �ӽ�100% | ��50% |
24СʱpH | �ӽ����� | �ӽ����� |
��������������̬ |
|
|
pH=4.5ʱ��NO3-��ȥ���ʵ͡���ԭ����____��
��4�����������루2����ͬ����1Сʱ�ⶨNO3-��ȥ���ʺ�pH��������£�
��ʼpH | pH=2.5 | pH=4.5 |
NO3-��ȥ���� | Լ10% | Լ3% |
1СʱpH | �ӽ����� | �ӽ����� |
�루2�������ݶԱȣ����ͣ�2���г�ʼpH��ͬʱ��NO3-ȥ���ʺ���������������̬��ͬ��ԭ��____��
����Ŀ����һ����ҵ�ϣ���Cu2O/ZnO �������������·�����Ӧ��CO(g)+2H2(g)CH3OH(g) ��H
��1����֪��CH3OH(l)=CH3OH(g) ��H=+35.2kJmol-1�����ݱ���
���� | H2(g) | CO(g) | CH3OH(l) |
ȼ����/kJmol-1 | -285.8 | -283.0 | -726.5 |
��ӦCO(g)+2H2(g)CH3OH(g) ��H=______kJmol-1
��2����2L�����ܱ�������ͨ��1mol CO(g)��2mol H2(g)��������Ӧ�ϳɼ״�����Ӧ������n(CH3OH)��ʱ��(t)���¶ȵĹ�ϵ��ͼ1��ʾ����500���ѹ�����£�����ͼ1�л�����Ӧ��ϵ��n(CH3OH)��ʱ�䣨t���仯������ͼ��
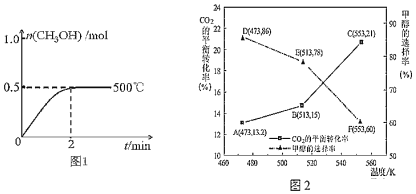 ____________
____________
�������״�������CO2��H2�ڴ���CZZA����ͨͭ�������������ºϳɣ���ط�Ӧ���£�
��Ӧ��CO2(g)+3H2(g)CH3OH(g)+H2O(g) ��H1=-49.2kJmol-1
��Ӧ��CO2(g)+H2(g)CO(g)+H2O(g) ��H2=41.2kJmol-1
��3����CZZA/rGOΪ��������һ�������£���1mol CO2��3mol H2ͨ������ܱ������н��з�ӦI�ͷ�ӦII��CO2��ƽ��ת���ʺͼ״���ѡ���ʣ��״���ѡ���ʣ�ת����CO2�����ɼ״������ʵ������������¶ȵı仯������ͼ2��ʾ��
����553Kʱ����Ӧ��ϵ��CO�����ʵ���Ϊ______ mol
�������¶ȵ����ߣ�CO2��ƽ��ת�������ӵ��״���ѡ���ʽ��ͣ��������ԭ��______
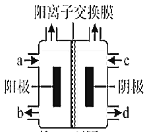
��������4����ͼΪ�ȼҵ��װ��ʾ��ͼ��a�˽��������Ϊ______����ҵ�ϻ��������ø�װ�ã����ļ��Ȼ��[(CH3)4NCl]ˮ��ҺΪԭ�ϣ�ͨ����ⷨ���Ʊ��ļ��������[(CH3)4NOH]�����ռ���(CH3)4NOH��������______����a��b��c��d����
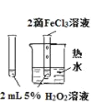
����Ŀ������ͼ�е�ʵ�飬�ܴﵽʵ��Ŀ�ĵ���
A | B | C | D | |
ʵ�鷽�� |
|
|
|
|
ʵ�� Ŀ�� | ��֤FeCl3��H2O2�ֽⷴӦ�д����� | �Ƚ�HCl��H2CO3��H2SiO3������ǿ�� | ��ȥSO2�е�����HCl | ȷ��ȡ20.00mL���K2Cr2O7����Һ |
A. AB. BC. CD. D