题目内容
4.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 12.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA | |
| C. | 7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA | |
| D. | 100mL0.1mol•L-1醋酸溶液含有的分子总数一定小于0.01NA |
分析 A.5.6g铁的物质的物质的量0.1mol,0.1mol铁完全反应消耗0.15mol氯气,氯气不足,转移的电子按照氯气的量计算;
B.铜与浓硫酸的反应中,随着反应的进行,浓硫酸变成稀硫酸,反应停止;
C.硫化钠和过氧化钠的摩尔质量都是78g/mol,过氧化钠中含有的阴离子为过氧根离子;
D.醋酸溶液中含有的分子为醋酸分子和水分子.
解答 解:A.5.6g铁的物质的物质的量0.1mol,0.1mol铁完全反应消耗0.15mol氯气,氯气不足,0.1mol氯气完全反应转移0.2mol电子,转移电子数为0.2NA,故A错误;
B.12.5mL 16mol•L-1浓硫酸中含有0.4mol硫酸,0.4mol硫酸与铜完全反应转移0.2mol电子,由于稀硫酸不与铜反应,则反应中转移电子数小于0.2NA,故B错误;
C.7.8g硫化钠和过氧化钠的物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,过氧化钠中的阴离子为过氧根离子,则0.1mol二者的混合物中含有0.1mol阴离子,含有的阴离子数等于0.1NA,故C正确;
D.100mL0.1mol•L-1醋酸溶液中含有溶质醋酸0.01mol,由于醋酸溶液中含有水分子,所以产生溶液中含有的分子总数大于0.01mol,含有的分子总数一定大于0.01NA,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,B、D为易错点,B注意稀硫酸不与铜反应、D需要明确醋酸中还含有水分子.

练习册系列答案
 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
14.化学反应A2+B2=2AB的能量变化如图所示.下列说法正确的是( )
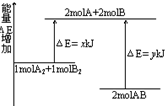

| A. | 该反应是吸热反应 | |
| B. | 生成2molAB需要吸收热量y-x kJ | |
| C. | 断裂1molA-A键和1molB-B键可放出xkJ能量 | |
| D. | 断裂2molA-B键需要吸收ykJ能量 |
15.不能发生消去反应的有机物是( )
| A. | CH3OH | B. | 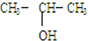 | ||
| C. | 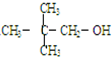 | D. | CH3-CH2-CH2-CH2OH |
12.在一个恒温恒容的密闭容器中发生如下反应,2A(g)+2B(s)?C(g)+3D(g),不能说明该反应达到平衡的是( )
| A. | 气体总质量不变 | |
| B. | 反应物B的物质的量浓度不变 | |
| C. | 混合气体的平均相对分子质量不变 | |
| D. | 物质C的生成速率和D的消耗速率之比为1:3 |
9.取A g某物质在氧气中完全燃烧,将其产物跟足量Na2O2固体完全反应,反应后固体质量增加大于A g,下列物质中能满足上述结果的是( )
| A. | H2 | B. | CH2O2 | C. | C6H12O6 | D. | C12H22O11 |
13.C、N、S是重要的非金属元素,下列说法正确的是( )
| A. | 实验室用铜和浓硝酸反应制取NO | |
| B. | 三种元素均可以和氧元素形成多种氧化物 | |
| C. | CO2、SO2、NO2都能与H2O反应,且原理相同 | |
| D. | 稀硫酸、稀硝酸与铁的反应均属于置换反应 |