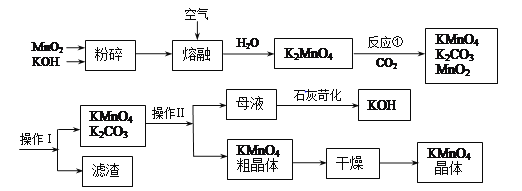
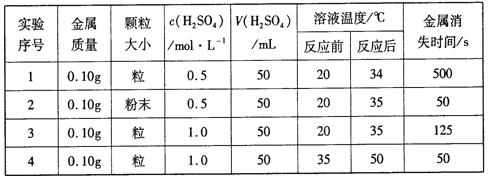
��Ŀ����
����Ŀ��I.ijѧϰС���������ͼװ����ȡSO2���о������ʣ�����һ��̽����ͬŨ�������������

��ش��������⣺
(1)B��C��D�ֱ����ڼ���SO2�����ʣ�д��C�з�Ӧ�����ӷ���ʽ________________��
(2)ʵ���й۲쵽D���л��dz��֣���ͬѧ�����������֤��SO2���������ԡ�
��������ɣ�______________________________________________��
(3)Eװ�õ�����Ϊ_____________________________��
��.ijѧϰС����Ʋ��������ʵ�飺��ȡһ�����Ļ�ԭ���۷���һ�������Ũ�����У����ȣ���ַ�Ӧ��õ���ҺX���ռ�������Y�������飬����Y�к���SO2��H2��
(4)��ҺX��һ���������еĽ�����������___________��������μ�����ҺX�и�����______________________��
(5)Ϊ�˲ⶨ����Y��SO2�ĺ�������2.24L(��״��)����Yͨ�뵽200.00mL 0.2000mol/L���Ը��������Һ�У���ַ�Ӧ��ȡ��20.00mL��Һת����ƿ�н��еζ�������Ũ��Ϊ0.0500mol/L��KHC2O4��Һ20.00mL��
�������£�0.05mol/L KHC2O4��Һ�У�c(C2O42-)>c(H2C2O4)���ζ�����ʱ����ҺӦװ��
___________(����������)�У��ζ��յ������Ϊ______________________________��
������Y��SO2�����ʵ�������Ϊ____________________��
���𰸡� ![]() װ��C�ӷ���������Ҳ����ʹDװ���г��ֻ��� β������������ Fe2+ ȡ������Һ�����еμ�K3[Fe��CN��3]��Һ��������ɫ������֤��ԭ��Һ�к���Fe2+ ��ʽ�ζ��� �������һ��KHC2O4��Һ��ƿ����Һ����ɫ��Ϊ��ɫ��������ɫ���ָ� 90��
װ��C�ӷ���������Ҳ����ʹDװ���г��ֻ��� β������������ Fe2+ ȡ������Һ�����еμ�K3[Fe��CN��3]��Һ��������ɫ������֤��ԭ��Һ�к���Fe2+ ��ʽ�ζ��� �������һ��KHC2O4��Һ��ƿ����Һ����ɫ��Ϊ��ɫ��������ɫ���ָ� 90��
��������(1) C�б�����ˮ���������Ӧ������������ᣬ��Ӧ�����ӷ���ʽΪ![]() ��(2) װ��C�ӷ���������Ҳ������Dװ���г��ֻ��ǣ���ʵ���й۲쵽D���л��dz��֣�����֤��SO2���������ԣ�(3)������������Ⱦ���壬����ֱ���ŷŵ������У����ð������գ�Eװ�õ�����Ϊβ��������������(4)���ŷ�Ӧ�Ľ��У�����Ũ�Ƚ��ͣ����������庬����������һ����������ϡ���ᷴӦ�������������������ķ�Ӧ������ҺX��һ���������еĽ�����������Fe2+��������ҺX��Fe2+�ķ�����ȡ������Һ�����еμ�K3[Fe��CN��3]��Һ��������ɫ������֤��ԭ��Һ�к���Fe2+��(5) �ٱ���ҺKHC2O4��Һ�У�c(C2O42-)>c(H2C2O4)������Һ�����ԣ��ζ�����ʱ����ҺӦװ����ʽ�ζ����У��ζ��յ������Ϊ�������һ��KHC2O4��Һ��ƿ����Һ����ɫ��Ϊ��ɫ��������ɫ���ָ����ڸ��ݷ�Ӧ2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+��2MnO4-+5HC2O4-+3H+=2Mn2++10CO2��+2H2O��֪�������������ĵĸ�����ص����ʵ���Ϊ0.2L��0.2000mol/L-
��(2) װ��C�ӷ���������Ҳ������Dװ���г��ֻ��ǣ���ʵ���й۲쵽D���л��dz��֣�����֤��SO2���������ԣ�(3)������������Ⱦ���壬����ֱ���ŷŵ������У����ð������գ�Eװ�õ�����Ϊβ��������������(4)���ŷ�Ӧ�Ľ��У�����Ũ�Ƚ��ͣ����������庬����������һ����������ϡ���ᷴӦ�������������������ķ�Ӧ������ҺX��һ���������еĽ�����������Fe2+��������ҺX��Fe2+�ķ�����ȡ������Һ�����еμ�K3[Fe��CN��3]��Һ��������ɫ������֤��ԭ��Һ�к���Fe2+��(5) �ٱ���ҺKHC2O4��Һ�У�c(C2O42-)>c(H2C2O4)������Һ�����ԣ��ζ�����ʱ����ҺӦװ����ʽ�ζ����У��ζ��յ������Ϊ�������һ��KHC2O4��Һ��ƿ����Һ����ɫ��Ϊ��ɫ��������ɫ���ָ����ڸ��ݷ�Ӧ2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+��2MnO4-+5HC2O4-+3H+=2Mn2++10CO2��+2H2O��֪�������������ĵĸ�����ص����ʵ���Ϊ0.2L��0.2000mol/L- ![]() ��10��0.05000mol/L��0.02L=0.036mol������Y��SO2�����ʵ�������Ϊ
��10��0.05000mol/L��0.02L=0.036mol������Y��SO2�����ʵ�������Ϊ ��
��

����Ŀ���±���Ԫ�����ڱ���һ���֣����ݱ��и�����10��Ԫ�أ��ش��������⣮
���� �� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
2 | C | N | O | F | Ne | |||
3 | Na | Al | P | S | Cl |
��1�����ʵĻ�ѧ�������o��Ԫ������
��2������ԭ�ӽṹʾ��ͼ����
��3���γɻ�������������Ԫ������
��4��HF��H2O�У����ȶ��Խ�ǿ������
��5��N��P�У�ԭ�Ӱ뾶��С������
��6�������£�����Ũ�����з����ۻ��Ľ�������
��7��Ԫ������������Ӧˮ�����У�������ǿ�������ѧʽ����������ǿ�������H2SO4����HClO4������
��8�����һ���������ʹƷ����Һ��ɫ��д����������Ļ�ѧʽ �� ������Ԫ�غ���Ԫ�ص�������m��S����m��O��= �� �����ԭ��������S��32��O��16��