题目内容
【题目】下表是稀硫酸与某金属反应的实验数据:
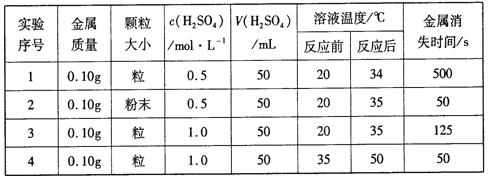
分析上述数据,回答下列问题:
(1)实验1和2表明,_____对反应速率有影响;实验1和3表明,______对反应速率与影响。
(2)室温下,将完全相同的锌片分别投入100mL0.1mol/L的稀硫酸和100mL0.2mol/L的稀盐酸中,仔细观察后发现,两者反应速率有明显差异:投入到稀硫酸中的锌表面产生的气泡没有投入到稀盐酸中的快。经分析讨论大家认为产生这一现象的原因有两种可能:
a、氯离子对反应起了促进作用,即氯离子加快了反应的进行;
b、____(你的观点)。
要证明你的观点,可以在室温下,分别取100mL0.1mol/L的盐酸溶液于两个相同的烧杯中,一个烧杯中加一定量的____固体(填所加试剂化学式),另一个烧杯作对比实验,再分别同时加入完全相同的锌片,比较两烧杯中反应速率的大小。
(3)在用锌粒和稀硫酸反应制取氢气时,往往加人少量CuSO4粉末,可加快产生H2的速率,其原因是_________(用文字表达)。
【答案】 固体的表面积 反应物浓度 SO42-离子对反应起抑制作用 Na2SO4 锌置换出铜,附在锌表面,在酸中形成铜锌原电池,加快反应速率
【解析】(1)其它条件相同,分析固体的表面积、反应物浓度对反应速率的影响规律。
(2)溶液中含有同浓度的氢离子,但是阴离子种类不同,探究阴离子对反应速率的影响的规律。
(3)锌铜和硫酸构成原电池,能够加快反应的速率。
(1)实验1和2中金属的状态不同,其它条件几乎相同,表明固体反应物的表面积对反应速率有影响,而且表面积越大,则反应速率越快;实验1和3中只有反应物的浓度不同,其它条件几乎相同,根据实验1和3可知,反应物浓度对反应速率产生影响,且浓度越大,反应速率越快;正确答案:固体的表面积;反应物浓度。
(2)100mL0.1mol/L的稀硫酸和100mL0.2mol/L的稀盐酸,两溶液中氢离子的浓度相同,但是阴离子不同,因此a、氯离子对反应起了促进作用,即氯离子加快了反应的进行;b、SO42-离子对反应起抑制作用;要证明上述观点,可以在室温下,分别取100mL0.1mol/L的盐酸溶液于两个相同的烧杯中,一个烧杯中加一定量的硫酸钠固体,另一个烧杯作对比实验,再分别同时加入完全相同的锌片,比较两烧杯中反应速率的大小,证明得出的结论;正确答案:SO42-离子对反应起抑制作用; Na2SO4 。
(3)在用锌粒和稀硫酸反应制取氢气时,往往加人少量CuSO4粉末,锌置换出铜,附在锌表面,在酸中形成铜锌原电池,加快反应速率;正确答案:锌置换出铜,附在锌表面,在酸中形成铜锌原电池,加快反应速率。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案