题目内容
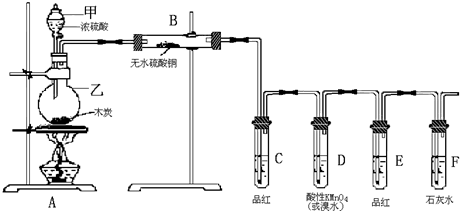
1.某化学学习小组为了解硫酸及其盐的某些性质和用途,进行了如下实验探究.【实验一】探究浓硫酸的氧化性:(图1)
(1)写出烧瓶中反应的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)B装置可用于探究SO2的还原性,则B中所用的试剂为:高锰酸钾溶液、氯水、溴水、氯化铁溶液等(任写一种即可);若B装置是品红溶液,则B中的现象是品红溶液褪色.
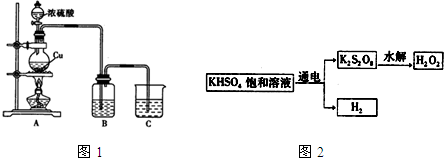
【实验二】检验(NH4)2Fe(SO4)2•6H2O中的金属离子:(图2)
(3)请结合化学用语和必要的文字说明如何检验出其中的金属离子(试剂、原理、现象等):取少许于试管中,配成溶液,滴加K3[Fe(CN)6]溶液,发生反应:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,有蓝色沉淀生成[或滴加KSCN溶液无明显现象,再滴加新制的氯水,变为红色,反应为:2Fe2++Cl2=2Fe3++2Cl-,Fe3++3SCN-=Fe(SCN)3;或滴加NaOH溶液产生白色沉淀:Fe2++2OH-=Fe(OH)2↓,并迅速变为灰绿色,最终变为红褐色:4Fe(OH)2+O2+2H2O=4Fe(OH)3]
【实验三】用KHSO4制取H2O2并测其质量分数:
查阅资料得知:工业上用如下原理制取制取H2O2:(图2)
现用此法制取一定浓度的H2O2,并测定H2O2的质量分数.
已知:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
①取10.00mL H2O2溶液(密度为1.00g/mL)置于锥形瓶中加水稀释,并加稀硫酸酸化;
②用0.200 0mol/L KMnO4溶液滴定;
③用同样方法滴定四次,消耗KMnO4溶液的体积分别为:40.00mL、39.98mL、42.02mL、40.02mL.
(4)用该原理制取H2O2的阳极电极反应式为2SO42--2e-=S2O82-.
(5)进行操作②时,滴入第一滴KMnO4溶液,溶液的紫红色消失很慢,随着滴定的进行,溶液的紫红色消失速率加快,推测其原因可能是Mn2+作催化剂,加快反应速率.
(6)此H2O2溶液中溶质的质量分数为6.8%.
分析 【实验一】(1)烧瓶中发生反应为Cu与浓硫酸反应生成硫酸铜、二氧化硫与水;
(2)B装置可用于探究SO2的还原性,则B中所用的试剂应具有强氧化性;若B装置是品红溶液,二氧化硫具有漂白性,使品红溶液褪色;
【实验二】(3)含有金属离子为Fe2+,可以用K3[Fe(CN)6]溶液检验,或者用KSCN溶液、新制的氯水检验,或者利用氢氧化亚铁转化为氢氧化铁特殊现象检验;
【实验三】(4)由图2可知,电解饱和KHSO4溶液生成氢气与S2O82-,阳极发生氧化反应,SO42-在阳极放电生成S2O82-;
(5)发生反应:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,随反应进行溶液中Mn2+浓度增大,可能是Mn2+起催化剂作用;
(6)消耗酸性高锰酸钾溶液体积中42.02mL与其它数据相差较大,应舍弃,计算其它三次体积的平均值为消耗酸性高锰酸钾溶液的体积,根据2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑计算10mL过氧化氢溶液中H2O2的质量,进而计算其质量分数.
解答 解:【实验一】(1)烧瓶中发生反应为Cu与浓硫酸反应生成硫酸铜、二氧化硫与水,化学反应方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)B装置可用于探究SO2的还原性,则B中所用的试剂应具有强氧化性,如:高锰酸钾溶液、氯水、溴水、氯化铁溶液等;若B装置是品红溶液,二氧化硫具有漂白性,品红溶液褪色,
故答案为:高锰酸钾溶液、氯水、溴水、氯化铁溶液等;品红溶液褪色;
【实验二】(3)含有金属离子为Fe2+,可以用K3[Fe(CN)6]溶液检验,或者用KSCN溶液、新制的氯水检验,或者利用氢氧化亚铁转化为氢氧化铁特殊现象检验,具体实验方案为:取少许于试管中,配成溶液,滴加K3[Fe(CN)6]溶液,发生反应:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,有蓝色沉淀生成[或滴加KSCN溶液无明显现象,再滴加新制的氯水,变为红色,反应为:2Fe2++Cl2=2Fe3++2Cl-,Fe3++3SCN-=Fe(SCN)3;或滴加NaOH溶液产生白色沉淀:Fe2++2OH-=Fe(OH)2↓,并迅速变为灰绿色,最终变为红褐色:4Fe(OH)2+O2+2H2O=4Fe(OH)3 ],
故答案为:取少许于试管中,配成溶液,滴加K3[Fe(CN)6]溶液,发生反应:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,有蓝色沉淀生成[或滴加KSCN溶液无明显现象,再滴加新制的氯水,变为红色,反应为:2Fe2++Cl2=2Fe3++2Cl-,Fe3++3SCN-=Fe(SCN)3;或滴加NaOH溶液产生白色沉淀:Fe2++2OH-=Fe(OH)2↓,并迅速变为灰绿色,最终变为红褐色:4Fe(OH)2+O2+2H2O=4Fe(OH)3];
【实验三】(4)由图2可知,电解饱和KHSO4溶液生成氢气与S2O82-,阳极发生氧化反应,SO42-在阳极放电生成S2O82-,电极反应式为:2SO42--2e-=S2O82-,
故答案为:2SO42--2e-=S2O82-;
(5)发生反应:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,随反应进行溶液中Mn2+浓度增大,可能是Mn2+起催化剂作用,加快反应速率,
故答案为:Mn2+作催化剂,加快反应速率;
(6)消耗酸性高锰酸钾溶液体积中42.02mL与其它数据相差较大,应舍弃,消耗酸性高锰酸钾溶液的体积为(40.00mL+39.98mL+40.02mL)÷3=40.00mL,根据2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑可知,10mL过氧化氢溶液中H2O2的质量为:0.04L×0.200 0mol/L×$\frac{5}{2}$×34g/mol=0.68g,H2O2溶液的质量为10mL×1.00g/mL=10g,故H2O2溶液中溶质的质量分数为$\frac{0.68g}{10g}$×100%=6.8%,
故答案为:6.8%.
点评 本题考查实验方案设计、物质性质探究、电解原理、氧化还原反应滴定等,是对学生综合能力的考查,需要学生具备扎实的基础上与灵活运用知识的能力,难度中等.

 有多种同分异构体,其中属于酯类且结构中含有苯环和甲基的同分异构体有( )
有多种同分异构体,其中属于酯类且结构中含有苯环和甲基的同分异构体有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | $\frac{W}{W+18a}$×100% | B. | $\frac{W}{W+36a}$×100% | ||
| C. | $\frac{7100W}{161(W+18a)}$×100% | D. | $\frac{7100W}{161(W+36a)}$×100% |