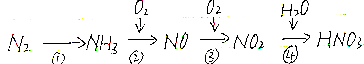题目内容
11.化合价为m的某元素的硝酸盐的相对分子质量为n,则该元素的相对原子质量为n-62m.分析 化合价为m的某元素的硝酸盐,设该元素为R,则该硝酸盐的化学式为R(NO3)m,结合相对原子质量之和等于相对分子质量计算.
解答 解:化合价为m的某元素的硝酸盐,设该元素为R,则该硝酸盐的化学式为R(NO3)m,设该元素的相对原子质量为A,则A+62m=n,A=n-62m,
故答案为:n-62m.
点评 本题考查相对原子质量的计算,难度不大,根据化学式进行计算即可.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.下列有机物中,既能发生加成、酯化反应,又能发生氧化反应的是( )
①CH2(CHOH)4CHO ②CH3CH2CH2OH ③CH2=CHCH2OH ④CH2=CHCOCHO ⑤CH2=CHCOOH.
①CH2(CHOH)4CHO ②CH3CH2CH2OH ③CH2=CHCH2OH ④CH2=CHCOCHO ⑤CH2=CHCOOH.
| A. | ③⑤ | B. | ①③⑤ | C. | ②④ | D. | ①③ |
16.白藜芦醇的结构简式为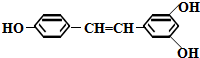 ,仅改变羟基(-OH)在苯环上的位置,且每个苯环上均含有羟基,可得到白藜芦醇的同分异构体甲,则甲可能的结构有( )
,仅改变羟基(-OH)在苯环上的位置,且每个苯环上均含有羟基,可得到白藜芦醇的同分异构体甲,则甲可能的结构有( )
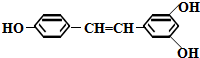 ,仅改变羟基(-OH)在苯环上的位置,且每个苯环上均含有羟基,可得到白藜芦醇的同分异构体甲,则甲可能的结构有( )
,仅改变羟基(-OH)在苯环上的位置,且每个苯环上均含有羟基,可得到白藜芦醇的同分异构体甲,则甲可能的结构有( )| A. | 13种 | B. | 15种 | C. | 17种 | D. | 19种 |
18.下列关于有机化合物的说法正确的是( )
| A. | 乙醇和乙酸均能与钠反应生成氢气 | |
| B. | 煤的干馏、油脂的皂化和石油的分馏都属于化学变化 | |
| C. | 丙烷(C3H8)和乙醇(C2H5OH)均存在同分异构体 | |
| D. | 糖类、油脂、蛋白质均属于高分子化合物 |