题目内容
14.A、B、C、D、E、F代表6种元素.请填空:(1)A元素基态原子的最外层有2个未成对电子,次外层有2个电子,其元素符号为C或O;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为Cl,C的元素符号为K;
(3)D元素的正三价离子的3d能级为半充满,D的元素符号为Fe,其基态原子的电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2;
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为Cu,其基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1.
(5)F元素的原子最外层电子排布式为nsnnpn+1,则n=2;原子中能量最高的是2p电子.
分析 根据原子或离子的核外电子排布确定元素的质子数,可确定元素的种类,
(1)A元素基态原子的最外层有2个未成对电子,次外层有2个电子,根据构造原理可知,核外有4或6个电子;
(2)B-和C+的电子层结构都与氩相同,分别为Cl和K元素;
(3)D3+的3d亚层为半充满,为Fe元素,原子序数为26,根据构造原理写出电子排布式;
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,应为Cu,原子序数为29,根据构造原理写出电子排布式;
(5)F元素的原子最外层电子排布式为nsnnpn+1,s能级最多排2个电子,该元素排列了p能级说明s能级已经填满,所以n=2,则该元素最外层电子排布式为2s22p3,p轨道能量大于s轨道电子能量.
解答 解:(1)A元素基态原子的最外层有2个未成对电子,次外层有2个电子,根据构造原理可知,核外有6或8个电子,所以该元素为C或O,
故答案为:C或O;
(2)B-和C+的电子层结构都与氩相同,分别为Cl和K元素,
故答案为:Cl;K;
(3)D3+的3d亚层为半充满,其基态原子的电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2,为Fe;
故答案为:Fe;1s22s22p63s23p63d64s2或[Ar]3d64s2;
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,应为Cu元素,
故答案为:Cu;1s22s22p63s23p63d104s1或[Ar]3d104s1;
(5)F元素的原子最外层电子排布式为nsnnpn+1,s能级最多排2个电子,该元素排列了p能级说明s能级已经填满,所以n=2,则该元素最外层电子排布式为2s22p3,则该元素是N元素,根据构造原理知该元素中能量最高的电子是2p电子.
故答案为:2;2p.
点评 本题考查元素推断、核外电子排布等,题目难度不大,注意掌握原子核外电子的排布规律,以此推断元素,注意基础知识的理解掌握.

| A. | 氖元素的相对原子质量一定是12a/b | |
| B. | W g该氖原子的物质的量一定是W/(aNA)mol | |
| C. | 该氖原子的摩尔质量是aNA g | |
| D. | W g该氖原子所含的质子数是10 W/(aNA) |
①CH2(CHOH)4CHO ②CH3CH2CH2OH ③CH2=CHCH2OH ④CH2=CHCOCHO ⑤CH2=CHCOOH.
| A. | ③⑤ | B. | ①③⑤ | C. | ②④ | D. | ①③ |
| A. | Na+、H+、Cu2+、NO3- | B. | Na+、Fe2+、H+、NO3- | ||
| C. | NH4+、Cl-、SO42-、OH- | D. | HCO3-、I-、Na+、OH- |
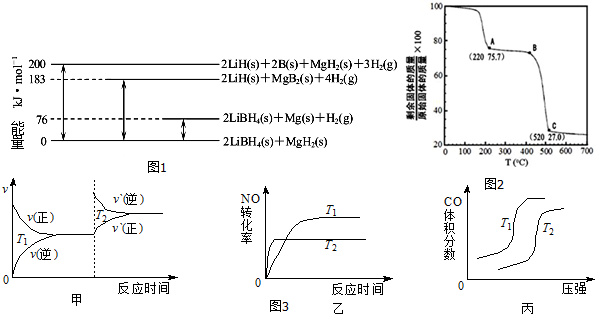
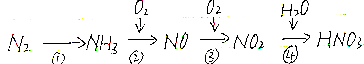
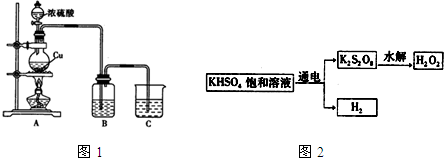
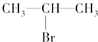 (主要产物),1mol某芳香烃A充分燃烧后可以得到8molCO2和4molH2O.该烃A在不同条件下能发生如下所示的一系列变化.
(主要产物),1mol某芳香烃A充分燃烧后可以得到8molCO2和4molH2O.该烃A在不同条件下能发生如下所示的一系列变化.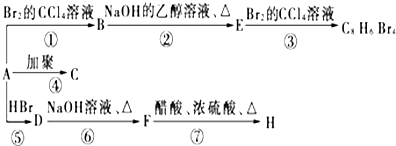

 ,D
,D ,E
,E ,F
,F .
.