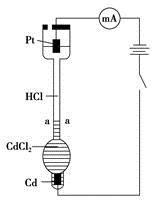
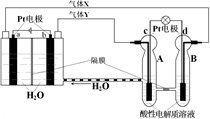
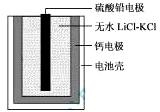
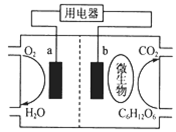
题目内容
某实验小组用以下几个实验装置探究电化学过程对金属与稀硫酸反应速率的影响, 烧杯中都盛有稀H2SO4。
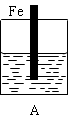
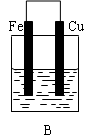
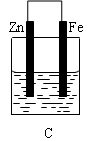
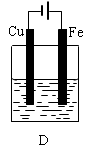
试回答:
(1)B装置中Cu电极上的电极反应式为 ,D装置中Fe电极上的电极反应式为 。
(2)D装置中的实验现象有 ,若用电流表测量反应时通过导线的电子流量为0.2mol,则Fe电极的质量变化为 。
(3)B、C两个装置中Fe片被腐蚀的速率更快的是 (填B或C)。




试回答:
(1)B装置中Cu电极上的电极反应式为 ,D装置中Fe电极上的电极反应式为 。
(2)D装置中的实验现象有 ,若用电流表测量反应时通过导线的电子流量为0.2mol,则Fe电极的质量变化为 。
(3)B、C两个装置中Fe片被腐蚀的速率更快的是 (填B或C)。
(1) 2H++2e-=H2 ↑,Fe-2e-=Fe2+。
(2)Cu电极上有气泡,Fe电极逐渐溶解,溶液逐渐变为浅绿色,减小5.6g。 (3)B
(2)Cu电极上有气泡,Fe电极逐渐溶解,溶液逐渐变为浅绿色,减小5.6g。 (3)B
试题分析:(1)在B装置中由于活动性Fe>Cu,所以Cu电极为原电池的正极,在正极上的电极反应式为2H++2e-=H2↑,D装置为电解池。由于在D装置中Fe电极与直流电源的正极相连接,所以为阳极。在Fe电极上的发生氧化反应,电极反应式为Fe-2e-=Fe2+。(2)在D装置中可看到的实验现象有Fe电极逐渐溶解消耗,在Cu电极上不断有气泡产生。同时溶液逐渐由无色变为浅绿色。若用电流表测量反应时通过导线的电子流量为0.2mol,因为Fe是+2价的金属,则Fe电极消耗的物质的量为0.1mol,由于Fed的摩尔质量为56g/mol,所以其质量变化为减少5.6g,(3)由于金属活动性Zn>Fe>Cu.所以在B装置中Fe为原电池的负极,被氧化而腐蚀;在C装置中Fe片作原电池的正极,首先被腐蚀的是活动性强的Zn,Fe被保护起来。因此在B、C两个装置中被腐蚀的速率更快的是B。

练习册系列答案
相关题目