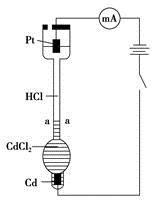
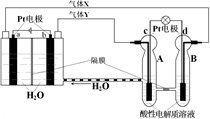
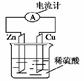
题目内容
A、J是日常生活中常见的两种金属,这两种金属和NaOH组成原电池,A作负极;F常温下是气体单质,各物质有以下的转化关系(部分产物及条件略去)。

请回答以下问题:
(1)写出该原电池的总反应方程式_____________________。
(2)写出②的化学方程_________________。
(3)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为 。(写出计算式)
(4)若③中J的氧化物为磁性氧化物,且每生成1mol J放出Q kJ的热量,请写出A→J反应的热化学方程式 。

请回答以下问题:
(1)写出该原电池的总反应方程式_____________________。
(2)写出②的化学方程_________________。
(3)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为 。(写出计算式)
(4)若③中J的氧化物为磁性氧化物,且每生成1mol J放出Q kJ的热量,请写出A→J反应的热化学方程式 。
(1)2Al+2NaOH +2H2O=2NaAlO2+ 3H2↑
(2)4NH3+5O2 4NO+6H2O
4NO+6H2O
(3)(10-2–10-12)mol·L-1 ,或c(OH-)–c(H+)
(4)3Fe3O4(S)+8Al(S)="9Fe" (S)+4 Al2O3(S) △H=-9Q kJ·mol-1
(2)4NH3+5O2
 4NO+6H2O
4NO+6H2O(3)(10-2–10-12)mol·L-1 ,或c(OH-)–c(H+)
(4)3Fe3O4(S)+8Al(S)="9Fe" (S)+4 Al2O3(S) △H=-9Q kJ·mol-1
由题意知,(1)由题意可推知:A是Al;J是Fe.当这两种金属和NaOH组成原电池,Al作负极,Fe作正极。该原电池的总反应方程式2Al +2NaOH +6H2O="2Na" AlO2+ 3 H2↑ C是NaAlO2,D是H2;E是Al(OH)3,H是Al2O3,M是FeS。F是N2,G是NH3,I是NO,K是NO2,L是HNO3。
(2)②的化学方程式为:4NH3+5O2 4NO+6H2O;
4NO+6H2O;
(3)常温时pH=12的C溶液中,C(H+)=1×10-12mol/L,
C(OH-)=Kw/C(H+)=(1×10-14)÷(1×10-12)=1×10-2mol/L。因为溶液呈电中性,所,以C(Na+)+C(H+)=C(AlO2-)+C(OH-),C(Na+)-C(AlO2-)=C(OH-)-C(H+)=(10-2-10-12)mol/L.(4)③中铝与Fe3O4反应的热化学方程式为:3Fe3O4(S)+ 8Al(S) =9Fe (S)+4 Al2O3(S) △H="-9Q" kJ·mol-1
(2)②的化学方程式为:4NH3+5O2
 4NO+6H2O;
4NO+6H2O;(3)常温时pH=12的C溶液中,C(H+)=1×10-12mol/L,
C(OH-)=Kw/C(H+)=(1×10-14)÷(1×10-12)=1×10-2mol/L。因为溶液呈电中性,所,以C(Na+)+C(H+)=C(AlO2-)+C(OH-),C(Na+)-C(AlO2-)=C(OH-)-C(H+)=(10-2-10-12)mol/L.(4)③中铝与Fe3O4反应的热化学方程式为:3Fe3O4(S)+ 8Al(S) =9Fe (S)+4 Al2O3(S) △H="-9Q" kJ·mol-1

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目



 (aq)
(aq) PbCO3(s)+SO42-(aq)
PbCO3(s)+SO42-(aq)