题目内容
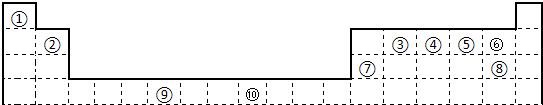
下表为长式周期表的一部分,其中的编号代表对应的元素.
请回答下列问题:
(1)表中属于d区的元素是______(填编号).
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图所示(图中②、④、⑨分别位于
晶胞的体心、顶点、面心),则该化合物的化学式为______(用对应的元素符号表示).
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是______.
A.分子中含有分子间的氢键 B.属于含有极性键的非极性分子
C.只含有4个sp-s的σ键和1个p-p的π键D.该氢化物分子中②原子采用sp2杂化
(4)某元素的价电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为______;该元素与元素①形成的18电子的X分子(分子量32)的电子式为______;该元素还可与元素①形成10电子的气体分子Y(分子量17),将过量的Y气体通入盛有硫酸铜水溶液的试管里,现象为______.
(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据.
请回答:表中的金属元素是______(填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是______.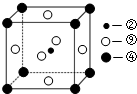
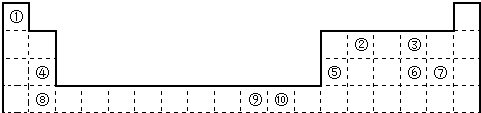
| ① | |||||||||||||||||
| ② | ③ | ||||||||||||||||
| ④ | ⑤ | ⑥ | ⑦ | ||||||||||||||
| ⑧ | ⑨ | ⑩ |
(1)表中属于d区的元素是______(填编号).
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图所示(图中②、④、⑨分别位于
晶胞的体心、顶点、面心),则该化合物的化学式为______(用对应的元素符号表示).
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是______.
A.分子中含有分子间的氢键 B.属于含有极性键的非极性分子
C.只含有4个sp-s的σ键和1个p-p的π键D.该氢化物分子中②原子采用sp2杂化
(4)某元素的价电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为______;该元素与元素①形成的18电子的X分子(分子量32)的电子式为______;该元素还可与元素①形成10电子的气体分子Y(分子量17),将过量的Y气体通入盛有硫酸铜水溶液的试管里,现象为______.
(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据.
| 电离能I(eV) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |

(1)长式周期表中的8、9、10三列元素的电子排布中出现d轨道,属于d区的元素,故答案为:⑨;
(2)根据长式元素周期表的结构,②、④、⑨分别为:C、Mg、Ni,分别位于晶胞的体心、顶点、面心,则晶胞中的原子数目之比为:1:(8×
):(6×
)=1:1:3,故答案为:MgCNi3或CMgNi3;
(3)乙烯是衡量一个国家石油发展水平的标志,乙烯中有双键和单键,其中双键中一个是σ键和1个p-p的π键,其余的4个碳氢键均为σ键,共5个sp-s的σ键和1个p-p的π键,中心原子碳原子采用sp2杂化方式,形成平面结构,是含有碳氢极性键的非极性分子,故答案为:BD;
(4)价电子排布式为nsnnpn+1,则n=2,即为氮元素,该元素原子的核外最外层电子的孤对电子数为1,氮元素与氢元素形成的18电子的X分子为N2H4(分子量32),属于共价化合物,电子式为:
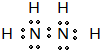
,氨气能和硫酸铜水溶液发生复分解反应,生成的氢氧化铜能和氨水继续络合,形成深蓝色的溶液,故答案为:1;
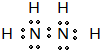
;先产生蓝色沉淀,后沉消失,变成深蓝色的溶液;
(5)根据表中的数据可以看出A、B、C的前四级电离能较小,而D、E、F的前三级电离能较小,原子失去电子的倾向决定于原子的电离能的大小,所以元素金属性也就由元素的原子电离能来衡量,如果电离能越小,说明气态时该原子越易失去电子,元素的金属性就越强,原子的p、d轨道处于半充满状态时更稳定,失电子较难,故答案为:DEF;B的np轨道上的电子半满,能量比A和C低,自身更稳定,所以第一电离能比A和C大.
(2)根据长式元素周期表的结构,②、④、⑨分别为:C、Mg、Ni,分别位于晶胞的体心、顶点、面心,则晶胞中的原子数目之比为:1:(8×
| 1 |
| 8 |
| 1 |
| 2 |
(3)乙烯是衡量一个国家石油发展水平的标志,乙烯中有双键和单键,其中双键中一个是σ键和1个p-p的π键,其余的4个碳氢键均为σ键,共5个sp-s的σ键和1个p-p的π键,中心原子碳原子采用sp2杂化方式,形成平面结构,是含有碳氢极性键的非极性分子,故答案为:BD;
(4)价电子排布式为nsnnpn+1,则n=2,即为氮元素,该元素原子的核外最外层电子的孤对电子数为1,氮元素与氢元素形成的18电子的X分子为N2H4(分子量32),属于共价化合物,电子式为:
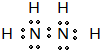
,氨气能和硫酸铜水溶液发生复分解反应,生成的氢氧化铜能和氨水继续络合,形成深蓝色的溶液,故答案为:1;
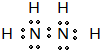
;先产生蓝色沉淀,后沉消失,变成深蓝色的溶液;
(5)根据表中的数据可以看出A、B、C的前四级电离能较小,而D、E、F的前三级电离能较小,原子失去电子的倾向决定于原子的电离能的大小,所以元素金属性也就由元素的原子电离能来衡量,如果电离能越小,说明气态时该原子越易失去电子,元素的金属性就越强,原子的p、d轨道处于半充满状态时更稳定,失电子较难,故答案为:DEF;B的np轨道上的电子半满,能量比A和C低,自身更稳定,所以第一电离能比A和C大.

练习册系列答案
相关题目