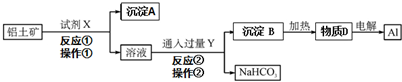
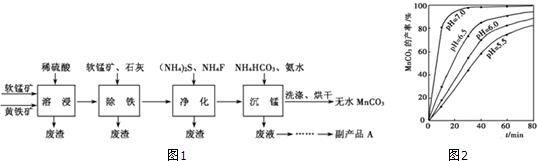
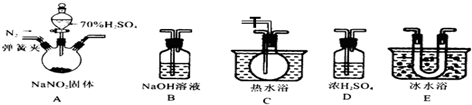
题目内容
13.2SO2(g)+O2(g)$\frac{\underline{\;V_{2}O_{5}\;}}{\;}$2SO3(g)△H<0是制备硫酸的重要反应.下列关于该反应的叙述不正确的是( )| A. | 降低温度将缩短反应达到平衡的时间 | |
| B. | 增大反应体系的压强反应速率一定增大 | |
| C. | 催化剂V2O5同时改变正逆反应速率 | |
| D. | 增加O2的浓度将提高SO2的转化率 |
分析 A、降温反应速率减慢;
B、增加压强不一定能增加反应速率,必须是提高反应物浓度(例如压缩体积),像充入惰性气体这样的方式,虽然增加了压强,但是反应速度依然不变;
C、催化剂可以同等程度的增大正、逆反应的反应速率;
D、增大一种反应物浓度,另一种反应物转化率增大.
解答 解:A.降低温度,活化分子百分数减小,反应速率减小,延长反应达到平衡的时间,故A错误;
B.增加压强不一定能增加反应速率,必须是提高反应物浓度(例如压缩体积),像充入惰性气体这样的方式,虽然增加了压强,但是反应速度依然不变,故B错误;C.催化剂可以同等程度的增大正、逆反应的反应速率,故C正确;
D.增加O2的浓度,平衡正向移动,二氧化硫转化率增大,故D正确;
故选AB.
点评 本题考查化学反应速率以及化学平衡的影响因素,注意相关基础知识的学习和积累,难度不大,注意可逆反应不能完全转化.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
3.日常生活用品中属于强电解质的是( )
| A. | 食盐 | B. | 食醋 | C. | 蔗糖 | D. | 水 |
1.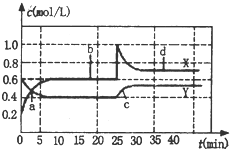 已知NO2和N2O4可以相互转化:2NO2 (g)?N2O4 (g)△H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图.下列说法错误的是( )
已知NO2和N2O4可以相互转化:2NO2 (g)?N2O4 (g)△H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图.下列说法错误的是( )
 已知NO2和N2O4可以相互转化:2NO2 (g)?N2O4 (g)△H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图.下列说法错误的是( )
已知NO2和N2O4可以相互转化:2NO2 (g)?N2O4 (g)△H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图.下列说法错误的是( )| A. | 图中共有两条曲线X和Y,其中曲线X表示 NO2浓度随时间的变化 | |
| B. | a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d | |
| C. | 若要达到与d相同的状态,在25min时还能采取的措施是适当缩小容器体积 | |
| D. | 反应进行至25min时,曲线发生变化的原因是加入0.4 mol N2O4 |
18.下列说法不正确的是( )
| A. | 煤、石油、天然气都是化石燃料,都是非再生能源,都是一级能源 | |
| B. | 电能、水煤气、氢气都是二级能源,要靠其他能源才能制取 | |
| C. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| D. | 凡含有食品添加剂的食物对人体均有害,不可食用 |
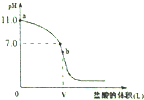 常温时,向浓度为0.1mol/L体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而变化的滴定曲线如图所示,b点表示两种溶液恰好完全反应.
常温时,向浓度为0.1mol/L体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而变化的滴定曲线如图所示,b点表示两种溶液恰好完全反应.