题目内容
下列有关说法正确的是( )
| A、用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物 |
| B、镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的 |
| C、取一定量水垢加盐酸,生成能使澄清石灰水变浑浊的气体,说明水垢的主要成分为CaCO3、MgCO3 |
| D、已知Cu2O+2H+═Cu2++Cu+H2O,氢气还原氧化铜后所得红色固体能完全溶于稀硝酸,说明还原产物是铜 |
考点:金属的电化学腐蚀与防护,硅和二氧化硅,钠的重要化合物,铜金属及其重要化合物的主要性质
专题:元素及其化合物
分析:A.高温下,瓷坩埚中的二氧化硅与碳酸钠反应;
B.牺牲阳极的阴极保护法指的是原电池的负极金属易被腐蚀,而正极金属被保护的原理,为防止钢铁被腐蚀,应连接活泼性较强的金属;
C.能与酸反应生成能使澄清石灰水变浑浊的二氧化碳气体只能说明含有碳酸盐,可能还有其它成分;
D.氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,Cu2O在酸性溶液中可发生自身氧化还原反应.
B.牺牲阳极的阴极保护法指的是原电池的负极金属易被腐蚀,而正极金属被保护的原理,为防止钢铁被腐蚀,应连接活泼性较强的金属;
C.能与酸反应生成能使澄清石灰水变浑浊的二氧化碳气体只能说明含有碳酸盐,可能还有其它成分;
D.氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,Cu2O在酸性溶液中可发生自身氧化还原反应.
解答:
解:A.高温下,瓷坩埚中的二氧化硅与碳酸钠反应,导致坩埚炸裂,故A错误;
B.在电化学中,阳极是失电子发生氧化反应的电极,牺牲阳极的阴极保护法中,阳极指的是负极,为减缓电解质溶液中铁片的腐蚀,应选择比铁活泼的金属做负极,镀锌铁板选择锌做阳极,故B正确;
C.取一定量水垢加盐酸,生成能使澄清石灰水变浑浊的气体,只能说明含有碳酸根离子,不能说明水垢的主要成分为CaCO3、MgCO3,可能含有Ca(OH)2、Mg(OH)2等,故C错误;
D.氢气还原氧化铜后所得红色固体,产物可能是Cu或Cu2O,Cu和Cu2O均为不溶于水的红色固体,但都能完全溶于稀硝酸,所以还原产物可能是Cu或Cu2O或两者混合物,故D错误;
故选B.
B.在电化学中,阳极是失电子发生氧化反应的电极,牺牲阳极的阴极保护法中,阳极指的是负极,为减缓电解质溶液中铁片的腐蚀,应选择比铁活泼的金属做负极,镀锌铁板选择锌做阳极,故B正确;
C.取一定量水垢加盐酸,生成能使澄清石灰水变浑浊的气体,只能说明含有碳酸根离子,不能说明水垢的主要成分为CaCO3、MgCO3,可能含有Ca(OH)2、Mg(OH)2等,故C错误;
D.氢气还原氧化铜后所得红色固体,产物可能是Cu或Cu2O,Cu和Cu2O均为不溶于水的红色固体,但都能完全溶于稀硝酸,所以还原产物可能是Cu或Cu2O或两者混合物,故D错误;
故选B.
点评:本题考查了元素化合物知识,侧重考查了电化学知识、铜的性质,掌握牺牲阳极的阴极保护法原理是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
用下列实验装置进行相应实验,能达到实验目的是( )
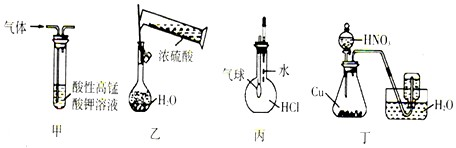

| A、装置甲:除去乙烯中混有的少量SO2 |
| B、装置乙:用浓硫酸配制1mol/L的硫酸 |
| C、装置丙:检验HCl气体在水中的溶解性 |
| D、装置丁:用铜和浓硝酸反应制取NO2 |
“化学无处不在”,下列与化学有关的说法正确的是( )
| A、聚乙烯塑料的老化是因为发生了加成反应 |
| B、纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 |
| C、合成纤维、人造纤维及碳纤维都属于有机高分子材料 |
| D、向某溶液中加入茚三酮试剂,加热煮沸后溶液若出现紫蓝色,则该溶液含有氨基酸 |
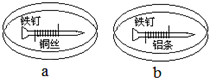 如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )
如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )| A、a中铁钉附近呈现红色 |
| B、b中铝条附近有气泡产生 |
| C、a中铜丝上发生氧化反应 |
| D、b中铁钉上发生还原反应 |
用下列实验装置进行相应实验,不能达到实验目的是( )
A、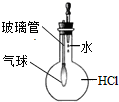 验证HCl极易溶于水 |
B、 石油分馏 |
C、 电解精炼铜 |
D、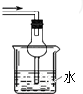 吸收氨气 |
下列有关实验操作正确的是( )
| A、用Ba(NO3)2溶液可以鉴别SO32-和SO42- |
| B、做H2还原CuO实验时要先通氢气,验纯后再加热 |
C、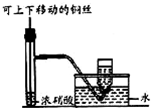 采用如图所示装置可制备并收集少量NO2气体 |
| D、测定相同温度下盐酸和醋酸溶液的pH,就可证明盐酸是强酸、醋酸是弱酸 |
在一定温度下,体积固定的密闭容器中进行可逆反应A(g)+3B(g)?2C(g),下列关于该反应达到平衡状态的标志的说法中不正确的是( )
| A、单位时间内生成n mol A,同时生成3n mol B |
| B、A、B、C的浓度不再发生变化 |
| C、混合气体的压强不再发生改变 |
| D、C生成的速率与C分解的速率相等 |
下列关于乙烯和苯的叙述中,错误的是( )
| A、乙烯能使酸性高锰酸钾溶液褪色 |
| B、两者都可以燃烧 |
| C、苯能使酸性高锰酸钾溶液褪色 |
| D、两者所有原子都在同一平面上 |
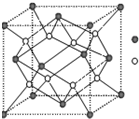 A-I为原子序数递增的前四周期的元素,已知A原子的最外层电子数是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族.E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属.H为应用最广泛的金属;I处于周期表中的第IIB族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)
A-I为原子序数递增的前四周期的元素,已知A原子的最外层电子数是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族.E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属.H为应用最广泛的金属;I处于周期表中的第IIB族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)