题目内容
(1)下列实验操作或对实验事实的描述不正确的有 (填序号)。
E.向饱和FeCl3溶液中滴加少量NaOH溶液,可制取Fe(OH)3胶体
F.除去CO2气体中混有的少量HCl,可以将气体通入饱和碳酸氢钠溶液
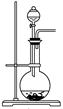
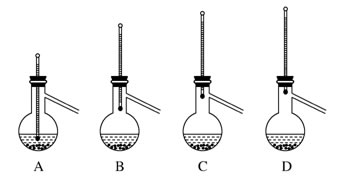
(2)下图为中学化学实验中常见的实验装置
A B C
实验室常用装置A制备下表中气体,请将分液漏斗和圆底烧瓶中应装的化学试剂填写完整。
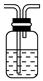
可用B装置排液收集气体,气体应从该装置________(填“左”“右”)管口导进,倘若利用该装置收集Cl2,试剂瓶中盛放的试剂为 。
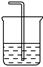
C装置用于处理多余气体对环境的污染,若利用该装置吸收Cl2,此时烧杯中发生反应的离子方程式为 。倘若该装置中仅仅盛放稀硫酸,通常不适合吸收氨气的原因是 ,若向烧杯中额外再加入一种液态有机物则可安全吸收氨气,这种有机物为 。
| A.用托盘天平称量17.55g氯化钠晶体 |
| B.碳酸钠溶液保存在带玻璃塞的试剂瓶 |
| C.用干燥的pH试纸测定新制氯水的pH |
| D.使用容量瓶配制溶液时,俯视刻度线定容后浓度偏大 |
F.除去CO2气体中混有的少量HCl,可以将气体通入饱和碳酸氢钠溶液
(2)下图为中学化学实验中常见的实验装置



A B C
实验室常用装置A制备下表中气体,请将分液漏斗和圆底烧瓶中应装的化学试剂填写完整。
| 气体 | O2 | Cl2 | NH3 |
| 分液漏斗中试剂 | | | 浓氨水 |
| 圆底烧瓶中试剂 | | KMnO4 | |
可用B装置排液收集气体,气体应从该装置________(填“左”“右”)管口导进,倘若利用该装置收集Cl2,试剂瓶中盛放的试剂为 。
C装置用于处理多余气体对环境的污染,若利用该装置吸收Cl2,此时烧杯中发生反应的离子方程式为 。倘若该装置中仅仅盛放稀硫酸,通常不适合吸收氨气的原因是 ,若向烧杯中额外再加入一种液态有机物则可安全吸收氨气,这种有机物为 。
(1)ABCE(4分 每多选1个或遗漏1个均扣1分)
(2)①(共4分)
②右 饱和食盐水
③Cl2+2OH-=ClO-+Cl-+H2O 氨气极易溶于水(稀硫酸),会引起倒吸
CCl4(或四氯化碳)
(2)①(共4分)
| 气体 | O2 | Cl2 | NH3 |
| 分液漏斗中试剂 | H2O2(或H2O) | 浓盐酸 | 浓氨水 |
| 圆底烧瓶中试剂 | MnO2(或Na2O2) | KMnO4 | NaOH(或CaO) |
③Cl2+2OH-=ClO-+Cl-+H2O 氨气极易溶于水(稀硫酸),会引起倒吸
CCl4(或四氯化碳)
试题分析:(1)A.用托盘天平称量只能精确到0.1g,错误;B.碳酸钠溶液呈碱性会和玻璃塞中的二氧化硅反应生成有粘性的物质硅酸钠,会使玻璃塞和玻璃瓶粘在一起,错误;C.用干燥的pH试纸测定新制氯水的pH,由于氯水有漂白性会使试纸发生变色无法观察,错误;D.使用容量瓶配制溶液时,俯视刻度线定容后浓度偏大,正确;E.在煮沸的蒸馏水中慢慢加入饱和FeCl3溶液直到生成红褐色液体,这是制取Fe(OH)3胶体 的常用方法,错误;F.除去CO2气体中混有的少量HCl,可以将气体通入饱和碳酸氢钠溶液,正确;故选为ABCE。(2)①下图分别是制备三种气体的原料
| 气体 | O2 | Cl2 | NH3 |
| 分液漏斗中试剂 | H2O2(或H2O) | 浓盐酸 | 浓氨水 |
| 圆底烧瓶中试剂 | MnO2(或Na2O2) | KMnO4 | NaOH(或CaO) |

练习册系列答案
相关题目
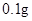
 —
— /日。
/日。 —
—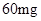 /日,治疗量
/日,治疗量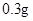 /日
/日