题目内容
下列实验操作或描述中正确的是( )
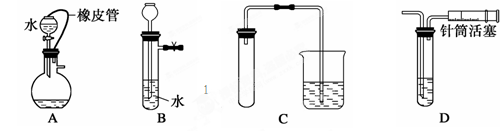
①要提纯混有少量KCl的硝酸钾时,先在较高温度下将混合物溶于水中形成浓溶液,然后冷却,就有大量硝酸钾晶体析出,再过滤,即可得到纯净的硝酸钾
②海带中碘元素的分离及检验时,需要向海带灰的浸取液中加入少量稀硫酸和过氧化氢溶液
③用加热法可以分离高锰酸钾和碘单质的混合物,因为碘单质受热易升华
④配制一定物质的量浓度的溶液时,将量取液态物质的量筒用水洗涤,洗涤液倒入容量瓶
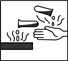
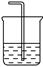
⑤将饱和氯水滴到淀粉碘化钾试纸上出现如图现象,说明低浓度氯水能将I—氧化成I2, 高浓度氯水能将I2进一步氧化成碘的化合物
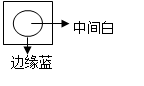
⑥将过量CO2通入Ca(ClO)2溶液得澄清溶液,说明H2CO3的酸性比HClO弱
①要提纯混有少量KCl的硝酸钾时,先在较高温度下将混合物溶于水中形成浓溶液,然后冷却,就有大量硝酸钾晶体析出,再过滤,即可得到纯净的硝酸钾
②海带中碘元素的分离及检验时,需要向海带灰的浸取液中加入少量稀硫酸和过氧化氢溶液
③用加热法可以分离高锰酸钾和碘单质的混合物,因为碘单质受热易升华
④配制一定物质的量浓度的溶液时,将量取液态物质的量筒用水洗涤,洗涤液倒入容量瓶
⑤将饱和氯水滴到淀粉碘化钾试纸上出现如图现象,说明低浓度氯水能将I—氧化成I2, 高浓度氯水能将I2进一步氧化成碘的化合物

⑥将过量CO2通入Ca(ClO)2溶液得澄清溶液,说明H2CO3的酸性比HClO弱
| A.①②⑤ | B.③⑤⑥ | C.①②④ | D.③④⑥ |
A
试题分析:①硝酸钾的溶解度随温度的降低而减小,所以降温结晶可得到纯净的硝酸钾,正确;②过氧化氢在酸性条件下可将I?氧化为I2,正确;③加热时KMnO4发生分解反应,错误;④用量筒量取液体时,不能把洗涤液转入容器,错误;⑤边缘部分氯水浓度低,为蓝色,说明低浓度氯水能将I—氧化成I2,中间氯水浓度大,为白色,说明高浓度氯水能将I2进一步氧化成碘的化合物。正确;⑥将过量CO2通入Ca(ClO)2溶液得澄清溶液,是因为CO2、H2O与CaCO3反应生成了能溶于水的Ca(HCO3)2,错误,故答案为A。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目