题目内容
【题目】下列说法正确的是
A. 常温下,向0.1mol·L-1的醋酸溶液中加水稀释,溶液中c(H+)/c(CH3COOH)增大
B. 反应N2(g)+3H2(g) ![]() 2NH3(g) (△H<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动
2NH3(g) (△H<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动
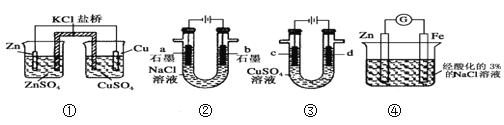
C. 镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的
D. 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属
【答案】AC
【解析】
A. 常温下,向0.1mol·L-1的醋酸溶液中加水稀释,c(H+),c(CH3COOH)均减小,因为稀释促进电离,所以溶液中c(H+)/c(CH3COOH)增大。故A正确;B. 反应N2(g)+3H2(g) ![]() 2NH3(g) (△H<0)达平衡后,降低温度,正反应速率减小、逆反应速率也减小,平衡向放热反应方向移动,即向正向移动。所以B错。C. 镀锌铁板在空气中会形成原电池,锌做负极被腐蚀,铁做正极被保护,故C正确; D. 电解精炼铜时,粗铜作阳极,精铜作阴极,Zn、Fe比铜活泼,所以失电子变成离子,阳极泥中含有的是Ag、Au等金属。故D错误。本题答案:A C。
2NH3(g) (△H<0)达平衡后,降低温度,正反应速率减小、逆反应速率也减小,平衡向放热反应方向移动,即向正向移动。所以B错。C. 镀锌铁板在空气中会形成原电池,锌做负极被腐蚀,铁做正极被保护,故C正确; D. 电解精炼铜时,粗铜作阳极,精铜作阴极,Zn、Fe比铜活泼,所以失电子变成离子,阳极泥中含有的是Ag、Au等金属。故D错误。本题答案:A C。

练习册系列答案
相关题目