题目内容
10.高铁信息传输系统中使用了光导纤维.光导纤维的主要成分是SiO2(写化学式)分析 光导纤维的主要成分是二氧化硅,据此解题.
解答 解:光导纤维的主要成分是二氧化硅,是利用光的全反射原理,故答案为:SiO2.
点评 本题考查化学用语以及硅和二氧化硅,注意物质的用途是解答的关键,注意知识的归纳和分类整合,注重基础知识的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列有关说法正确的是( )
| A. | 萃取操作可在普通漏斗中完成 | |
| B. | 浓烧碱液沾到皮肤上应立即用稀盐酸冲洗 | |
| C. | 用酒精灯加热试管内液体时一定要先给试管预热再集中加热液体部位 | |
| D. | 用托盘天平称出25.20g氯化钠 |
5.下列反应的离子方程式正确的是( )
| A. | 碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| B. | 25mL 0.3mol•L-1的FeBr2溶液中通入224mL标准状况下的氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| C. | 100mL 0.1mol•L-1的Al2(SO4)3溶液中加入20mL 3.5mol•L-1的NaOH溶液:Al3++4OH-═[Al(OH)4]- | |
| D. | 过量铁粉和稀硝酸反应:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O |
19.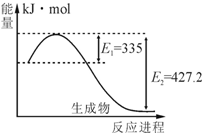 氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(1)已知:N2(g)+3H2(g)?2NH3(g),如图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量Q为46.1KJ;在该条件下向一密闭容器中充入0.5molN2和1.5mol H2,充分反应后,放出的热量<(填“<”、“>”或“=”)QkJ,理由是因为该反应是可逆反应,反应物不能完全转化.
氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(1)已知:N2(g)+3H2(g)?2NH3(g),如图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量Q为46.1KJ;在该条件下向一密闭容器中充入0.5molN2和1.5mol H2,充分反应后,放出的热量<(填“<”、“>”或“=”)QkJ,理由是因为该反应是可逆反应,反应物不能完全转化.
(2)在体积为2L的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,得到如下数据:
请回答下列问题:
①实验1中以υ(H2) 表示的反应速率为0.45mol/(L•min);
②下列各项能作为判断该反应达到化学平衡状态的依据的是C(填序号字母);
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B.υ(N2)(正)=3υ(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
③为提高H2平衡时的转化率,可以采取的措施有AC
A.通入过量的N2 B.升高温度 C.增大压强 D.通入过量的H2.
 氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(1)已知:N2(g)+3H2(g)?2NH3(g),如图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量Q为46.1KJ;在该条件下向一密闭容器中充入0.5molN2和1.5mol H2,充分反应后,放出的热量<(填“<”、“>”或“=”)QkJ,理由是因为该反应是可逆反应,反应物不能完全转化.
氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(1)已知:N2(g)+3H2(g)?2NH3(g),如图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量Q为46.1KJ;在该条件下向一密闭容器中充入0.5molN2和1.5mol H2,充分反应后,放出的热量<(填“<”、“>”或“=”)QkJ,理由是因为该反应是可逆反应,反应物不能完全转化.(2)在体积为2L的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,得到如下数据:
| 实验组 | 温度/℃ | 起始量/mol | 2分钟/mol | |
| H2 | N2 | NH3 | ||
| 1 | 298 | 6 | 2 | 1.2 |
| 2 | 398 | 3 | 1 | 0.8 |
①实验1中以υ(H2) 表示的反应速率为0.45mol/(L•min);
②下列各项能作为判断该反应达到化学平衡状态的依据的是C(填序号字母);
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B.υ(N2)(正)=3υ(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
③为提高H2平衡时的转化率,可以采取的措施有AC
A.通入过量的N2 B.升高温度 C.增大压强 D.通入过量的H2.
 A、B、C、D、E、F为原子序数依次增大的短周期元素,G为第四周期元素,B、C相邻且同周期,A、D同主族.A、C能形成两种化合物甲和乙,原子个数比分别为2:1和1:1,甲为常见的溶剂.E是地壳中含量最多的金属元素.F元素为同周期电负性最大的元素.D和F可形成化合物丙,E和F可形成化合物丁.G为第四周期未成对电子数最多的元素.请回答下列问题:
A、B、C、D、E、F为原子序数依次增大的短周期元素,G为第四周期元素,B、C相邻且同周期,A、D同主族.A、C能形成两种化合物甲和乙,原子个数比分别为2:1和1:1,甲为常见的溶剂.E是地壳中含量最多的金属元素.F元素为同周期电负性最大的元素.D和F可形成化合物丙,E和F可形成化合物丁.G为第四周期未成对电子数最多的元素.请回答下列问题: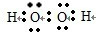 ,其分子内存在极性、非极性键.
,其分子内存在极性、非极性键.