��Ŀ����
20��T��ʱ�����ݻ�Ϊ1L���ݻ�Ϊ2L�ҵ��ܱ������У��ֱ����6mol A��3mol B��������Ӧ���£�3A��g��+b B��g��?3C��g��+2D��g������H��0.4min��������ڵķ�Ӧ�ﵽƽ�⣬A��Ũ��Ϊ2.4mol/L��B��Ũ��Ϊ1.8mol/L��t min���������ڵķ�Ӧ�ﵽƽ�⣬B��Ũ��Ϊ0.8mol/L�������������Ϣ�ش��������⣺��1���������з�Ӧ��ƽ������v ��B��=0.3mol/��L•min������ѧ����ʽ�м�����b=1��
��2���������з�Ӧ�ﵽƽ������ʱ��t����4min������ڡ�����С�ڡ����ڡ�����ԭ������������������ڼ��������������Ӧ��Ũ�ȼ�С����Ӧ���ʼ������ﵽƽ������Ҫ��ʱ���Ҫ����
��3��T��ʱ������һ�����������ͬ�ı������У�Ϊ�˴ﵽƽ��ʱB��Ũ����ȻΪ0.8mol/L����ʼʱ����������м���C��D�����ʵ����ֱ�Ϊ3mol��2mol���������A��B�����ʵ����ֱ���3mol��2mol��
��4����Ҫʹ�ס���������B��ƽ��Ũ����ȣ����Բ�ȡ�Ĵ�ʩ��AC
A�������¶Ȳ��䣬����������������2L
B����������������䣬ʹ�����������¶�
C����������ѹǿ���¶ȶ����䣬����м���һ������A����
D����������ѹǿ���¶ȶ����䣬����м���һ������B���壮
���� ��1������v=$\frac{��c}{��t}$����v��B��������Ũ�ȱ仯��֮�ȵ����仯ѧ������֮�ȼ���b��
��2��Ũ��ԽС����Ӧ�����Σ�����ƽ��ʱ��Խ����
��3��������Ϊ��ȫ��Чƽ�⣬����ѧ������ת�����������n��A��=6mol��n��B��=3mol���ݴ˼��㣻
��4�����ڸ÷�Ӧ���������Ŀ��淴Ӧ�����ڼ��������С����ѹǿ��ƽ�����������ƶ������з�Ӧ���ת����С���ң��Ҵﵽƽ��ʱͬ�����ʵ�Ũ�ȼ��д������еģ�
A�������¶Ȳ��䣬����������������2L�����ʱ����Ϊ��ȫ��Чƽ�⣻
B����������������䣬ʹ�����������¶ȣ��÷�ӦΪ���ȷ�Ӧ��ƽ�����������ƶ�������BŨ������
C����������ѹǿ���¶ȶ����䣬����м���һ������A���壬���ڷ�Ӧ��A��Ũ��������ƽ�����������ƶ�������B��Ũ�ȼ�С��
D����������ѹǿ���¶ȶ����䣬����м���һ������B���壬�ﵽƽ��ʱ����B��Ũ�ȸ���
��� �⣺��1��4min��������ڵķ�Ӧ�ﵽƽ��ʱB��Ũ��Ϊ1.8mol/L��B����ʼŨ��Ϊ3mol/L����v��B��=$\frac{3mol/L-1.8mol/L}{4min}$=0.3mol/��L•min����
�ﵽƽ��ʱ����c��A��=6mol/L-2.4mol/L=3.6mol/L����c��B��=3mol/L-1.8mol/L=1.2mol/L����3��b=3.6��1.2�����b=1��
�ʴ�Ϊ��0.3mol/��L•min����1��
��2�������������Ϊ1L�������������Ϊ2L����������������ڼģ�����Ũ��С��Ӧ������������ƽ���ʱ�䳤�������������з�Ӧ�ﵽƽ��ʱ����ʱ�����4min��
�ʴ�Ϊ�����ڣ� ��������������ڼ��������������Ӧ��Ũ�ȼ�С����Ӧ���ʼ������ﵽƽ������Ҫ��ʱ���Ҫ����
��3���������дﵽƽ��ʱB��Ũ����ȻΪ0.8mol/L��������Ϊ��ȫ��Чƽ�⣬����ѧ������ת������ߣ�����n��A��=6mol��n��B��=3mol���������м���C��D�����ʵ����ֱ�Ϊ3mol��2mol��ת������߿��Եõ�3molA��1molB���ʻ������A�����ʵ���Ϊ6mol-3mol=3mol����Ҫ����B�����ʵ���Ϊ3mol-1mol=2mol��
�ʴ�Ϊ��3mol��2mol��
��4�����ڸ÷�Ӧ���������Ŀ��淴Ӧ�����ڼ��������С����ѹǿ��ƽ�����������ƶ������з�Ӧ���ת����С���ң��Ҵﵽƽ��ʱͬ�����ʵ�Ũ�ȼ��д������еģ�
A�������¶Ȳ��䣬����������������2L�����ʱ����Ϊ��Чƽ�⣬�ס���������B��ƽ��Ũ����ȣ���A��ȷ��
B����������������䣬ʹ�����������¶ȣ��÷�ӦΪ���ȷ�Ӧ��ƽ�����������ƶ�������BŨ��������������ס���������B��ƽ��Ũ����ȣ���B����
C����������ѹǿ���¶ȶ����䣬����м���һ������A���壬���ڷ�Ӧ��A��Ũ��������ƽ�����������ƶ�������B��Ũ�ȼ�С������ʵ�ּס���������B��ƽ��Ũ����ȣ���C��ȷ��
D����������ѹǿ���¶ȶ����䣬����м���һ������B���壬�ﵽƽ��ʱ����B��Ũ�ȸ���������ס���������B��ƽ��Ũ����ȣ���D����
�ʴ�Ϊ��AC��
���� ���⿼�黯ѧƽ�������Ӱ�����ء���ѧ��Ӧ���ʼ��㡢��Чƽ��ȣ��Ѷ��еȣ���3����ע�������Чƽ����ɣ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | �ڢܢ� | B�� | �٢ۢ� | C�� | �٢ڢ� | D�� | ȫ�� |
| A�� | ���������ʹƷ����ɫ | |
| B�� | ����������뱽�ӻ��ʹ�� | |
| C�� | �������������ֻ���м��Լ� | |
| D�� | �����������ǻ����ᣨHOCH2COOH����Ϊͬ���칹�� |
| A�� | ��ҵ�ϳ��õ�ⷨ�Ʊ�Ԫ��C��D��E�ĵ��� | |
| B�� | Ԫ��A��B��ɵĻ����ﳣ����һ������̬ | |
| C�� | ������AE��CE������ͬ���͵Ļ�ѧ�� | |
| D�� | Ԫ��C��D������������Ӧ��ˮ����֮��϶����ܷ�����Ӧ |

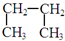 ��
��
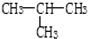
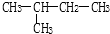 ��
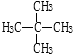
��
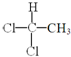 ��
��