题目内容
12.已知常压下酒精的沸点为78.6℃,工业酒精中含水量较多,制备无水乙醇时需要除水(1)为除去工业酒精中的水分,所加试剂为生石灰,进行的操作为蒸馏.
(2)为完成上述操作某同学设计了如下两套装置:

①用“→”标出上图装置a中冷却水进出的方向,用“…”画出装置b中所加液体液面的合适位置.
②你认为应该选用的合适装置是a(填“a”或“b”),
(3)检验上述除水过程中水是否除尽应选用的试剂是无水硫酸铜.
分析 生石灰容易吸收水生成氢氧化钙;
蒸馏是分离沸点不同,相互溶解的液体,过滤分离固体与液体的操作;
蒸馏时,冷凝水与蒸汽流向逆向冷凝效果最佳;过滤时分液漏斗液面低于滤纸边缘;
白色的无水硫酸铜与水反应生成蓝色晶体;
解答 解:(1)生石灰容易吸收水生成氢氧化钙,CaO与水反应后,增大与乙醇的沸点差异,沸点不同的相互溶解的液体,应选择蒸馏操作分离;
故答案为:生石灰;蒸馏;
(2)①蒸馏时,冷凝水与蒸汽流向逆向冷凝效果最佳,应该下口进上口出,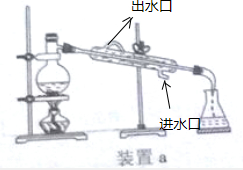 ;
;
过滤时分液漏斗液面低于滤纸边缘, ;
;
故答案为: ;
; ;
;
②分离酒精与氢氧化钙混合物应选择蒸馏操作选择a装置;
故答案为:a;
(3)白色的无水硫酸铜与水反应生成蓝色晶体,可以用无水硫酸铜检验酒精中是否含有水;
故答案为:无水硫酸铜.
点评 本题考查了物质分离的方法,熟悉蒸馏与过滤的原理是解题关键,注意蒸馏实验中温度计位置、冷凝水流向,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
2.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为NA个 | |
| B. | 通常状况下,NA 个CO2分子的体积为22.4L | |
| C. | 常温常压下,40gNaOH含有的钠离子个数为NA个 | |
| D. | 物质的量浓度为0.5mol/L的BaCL2溶液中,含有氯离子个数为NA个 |
3.下列说法正确的是( )
①CH3-CH=CH2和CH2=CH2的实验式相同
②CH≡CH和C6H6含碳量相同
③丁二烯和丁烯为同系物
④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤标准状况下,11.2L的己烷所含的分子数为0.5NA (NA为阿伏加德罗常数)
⑥能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振氢谱法.
①CH3-CH=CH2和CH2=CH2的实验式相同
②CH≡CH和C6H6含碳量相同
③丁二烯和丁烯为同系物
④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤标准状况下,11.2L的己烷所含的分子数为0.5NA (NA为阿伏加德罗常数)
⑥能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振氢谱法.
| A. | ①②④ | B. | ③⑤⑥ | C. | ②③⑥ | D. | ①④⑤ |
20.以NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移4NA个电子 | |
| B. | 含有NA个“Cu”微粒的CuO和Cu2S混合物质量为80g | |
| C. | 常温常压下,2.24L CO2和SO2混合气中氧原子数为0.2NA | |
| D. | 100mL0.1mol/L的NaCl溶液中,所含微粒总数为0.02NA |
7.现有下列物质:①Na2CO3•10H2O晶体;②锌;③HCl;④CO2;⑤NaHSO4固体;⑥Ba(OH)2溶液;⑦红褐色的氢氧化铁胶体;⑧氨水;⑨稀硫酸;⑩熔融NaCl;⑪蔗糖;按物质的分类方法填写表格的空白处(填编号).
| 分类标准 | 能导电的物质 | 电解质 | 酸 |
| 属于该类的物质 |
在100℃时,将0.40mol二氧化氮气体充入2L密闭容器中,每隔一段时间对该容器内的得到数据如下
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
下列说法中正确的是
A.反应开始20s内以二氧化氮表示的平均反应速率为0.00125mol·L-1·s-
B.80s时混合气体的颜色与60s时相同,比40s时的颜色深
C.80s时向容器中加入0.32mol氦气,同时将容器扩大为4L,则平衡将不移动
D.若起始投料为0.20molN2O4,相同条件下达平衡,则各组分含量与原平衡体系对应相等
 Cu3P+H3PO4+H2SO4,若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为 。
Cu3P+H3PO4+H2SO4,若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为 。