题目内容
在100℃时,将0.40mol二氧化氮气体充入2L密闭容器中,每隔一段时间对该容器内的得到数据如下
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
下列说法中正确的是
A.反应开始20s内以二氧化氮表示的平均反应速率为0.00125mol·L-1·s-
B.80s时混合气体的颜色与60s时相同,比40s时的颜色深
C.80s时向容器中加入0.32mol氦气,同时将容器扩大为4L,则平衡将不移动
D.若起始投料为0.20molN2O4,相同条件下达平衡,则各组分含量与原平衡体系对应相等
练习册系列答案
相关题目
4.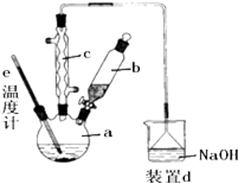 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如图:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如图:按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴.回答下列问题:
①装置c为球形冷凝管,冷凝水的水流方向为下进上出(填“上进下出”或“下进上出”).
②写出在a中发生的化学反应方程式2Fe+3Br2=2FeBr3、、C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr.
③装置d中NaOH溶液的作用是吸收HBr和Br2.
(2)液溴滴完后,经过下列步骤分离提纯:
Ⅰ向a中加入10mL水,然后过滤除去未反应的铁屑;
Ⅱ滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.
Ⅲ向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.
回答下列问题:
①纯溴苯为无色油状液体,而a中得到的粗产品呈褐色,则粗产品中溶解的主要杂质是Br2(填化学式).
②用10%的NaOH溶液洗涤的目的是除去溴苯中溶解的杂质,该杂质为Br2(填化学式).
③加入氯化钙的目的是干燥.
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母).
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL.
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如图:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如图:按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/°C | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶[来 | 微溶 |
①装置c为球形冷凝管,冷凝水的水流方向为下进上出(填“上进下出”或“下进上出”).
②写出在a中发生的化学反应方程式2Fe+3Br2=2FeBr3、、C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr.
③装置d中NaOH溶液的作用是吸收HBr和Br2.
(2)液溴滴完后,经过下列步骤分离提纯:
Ⅰ向a中加入10mL水,然后过滤除去未反应的铁屑;
Ⅱ滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.
Ⅲ向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.
回答下列问题:
①纯溴苯为无色油状液体,而a中得到的粗产品呈褐色,则粗产品中溶解的主要杂质是Br2(填化学式).
②用10%的NaOH溶液洗涤的目的是除去溴苯中溶解的杂质,该杂质为Br2(填化学式).
③加入氯化钙的目的是干燥.
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母).
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL.


 .
.
 CH3OH(g) △H<0
CH3OH(g) △H<0 CH4 (g)+H2O(g)
CH4 (g)+H2O(g)

