题目内容
20.以NA表示阿伏加德罗常数的值,下列说法中正确的是( )| A. | 在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移4NA个电子 | |
| B. | 含有NA个“Cu”微粒的CuO和Cu2S混合物质量为80g | |
| C. | 常温常压下,2.24L CO2和SO2混合气中氧原子数为0.2NA | |
| D. | 100mL0.1mol/L的NaCl溶液中,所含微粒总数为0.02NA |
分析 A.反应中只有氧元素的化合价升高由-1升高到0价,只有氯元素的化合价降低由0价降低到-1价,生成1mol氧气转移2mol电子;
B.CuO和Cu2S中铜元素的质量分数相等,都是80%;
C.常温常压,Vm≠22.4L/mol;
D.溶液由溶质与溶剂组成,所含微粒指代不明确,无法计算.
解答 解:A.在H2O2+Cl2=2HCl+O2反应中,反应中只有氧元素的化合价升高由-1升高到0价,只有氯元素的化合价降低由0价降低到-1价,生成氧气的物质的量为$\frac{32g}{32g/mol}$=1mol,所以转移2NA个电子,故A错误;
B.80gCuO和Cu2S的混合物中含有铜元素的质量为:80g×$\frac{64}{80}$=64g,含有的铜的物质的量为1mol,含有铜原子数为NA,故B正确;
C.常温常压,Vm≠22.4L/mol,Vm未知,无法计算气体的物质的量,故C错误;
D.100mL0.1mol/L的NaCl溶液中,所含溶质离子总共为0.1L×0.1mol/L×2×NAmol-1=0.02NA,溶液由溶质与溶剂组成,还包含溶剂微粒,故D错误;
故选:B.
点评 本题考查阿伏伽德罗常数的有关计算,明确物质的构成、发生的氧化还原反应、转移的电子数是解题关键,注意气体摩尔体积的条件应用,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
5.23.2g Fe3O4被浓硝酸氧化为Fe(NO3)3,失去电子( )
| A. | 0.1mol | B. | 1mol | C. | 0.3mol | D. | 3mol |
 .
.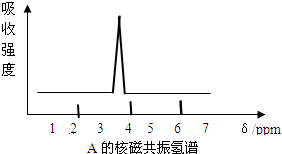 (1)按系统命名法命 (1)有机物CH3CH(C2H5)CH(CH3)2的名称是2,3-二甲基戊烷.
(1)按系统命名法命 (1)有机物CH3CH(C2H5)CH(CH3)2的名称是2,3-二甲基戊烷.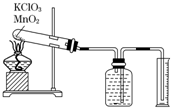 某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.
某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.