题目内容
14.将一定量的金属锌与100毫升18.3摩尔/升的浓硫酸充分反应,使锌完全溶解,生成的气体在标准状况下占有的体积为22.4升,将反应后所得的溶液稀释至1升,测得该溶液的氢离子浓度为1摩尔/升,则所生成的气体中SO2与H2的体积比是33:67.分析 根据n=$\frac{V}{{V}_{m}}$计算出标况下22.4L气体的物质的量;根据氢离子的物质的量计算出反应后剩余硫酸的物质的量,再根据n=cV计算出硫酸的总物质的量,从而得出反应中消耗硫酸的物质的量,然后根据反应方程式列式计算即可.
解答 解:生成气体的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,溶液稀释至1L,测得该溶液的氢离子浓度为1摩尔/升,属于硫酸的物质的量为0.5mol/L,
100毫升18.3摩尔/升的浓硫酸之间含有硫酸的物质的量为:18.3mol/L×0.1L=1.83mol,
则参加反应的硫酸的物质的量为:n(H2SO4)=1.83-0.5mol=1.33mol,
随着反应的进行,硫酸的浓度逐渐减小,反应会生成氢气,
设反应生成xmolSO2,ymolH2,
Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O
x 2x x
Zn+H2SO4(稀)=ZnSO4+H2↑
y y y
则:x+y=1、2x+y=1.33,
解得:x=0.33、y=0.67,
所以反应会生成0.33mol二氧化硫和0.67mol的氢气,
相同条件下气体的体积之比等于物质的量之比,则所生成的气体中SO2与H2的体积比为0.33mol:0.67mol=33:67,
故答案为:33:67.
点评 本题考查了混合物反应的计算,题目难度中等,注意掌握锌与浓硫酸、稀硫酸反应的方程式,明确混合物反应的计算方法与技巧,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系如图.甲和X不可能是( )
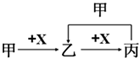
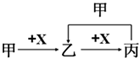
| A. | 甲为C,X为O2 | B. | 甲为Fe,X为Cl2 | ||
| C. | 甲为SO2,X为NaOH溶液 | D. | 甲为Fe,X为稀硝酸溶液 |
5.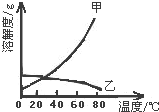 甲乙两种固体的溶解度曲线如图所示.有一个大烧杯中装着含有甲和乙的两种饱和溶液,而且杯中还有少量甲和乙的固体存在.现将温度由80℃降到20℃.下列说法错误的是( )
甲乙两种固体的溶解度曲线如图所示.有一个大烧杯中装着含有甲和乙的两种饱和溶液,而且杯中还有少量甲和乙的固体存在.现将温度由80℃降到20℃.下列说法错误的是( )
 甲乙两种固体的溶解度曲线如图所示.有一个大烧杯中装着含有甲和乙的两种饱和溶液,而且杯中还有少量甲和乙的固体存在.现将温度由80℃降到20℃.下列说法错误的是( )
甲乙两种固体的溶解度曲线如图所示.有一个大烧杯中装着含有甲和乙的两种饱和溶液,而且杯中还有少量甲和乙的固体存在.现将温度由80℃降到20℃.下列说法错误的是( )| A. | 杯中固体甲增多、固体乙减少 | |
| B. | 杯中一定有固体甲而不一定有固体乙 | |
| C. | 溶液中溶质甲减少、溶质乙增多 | |
| D. | 甲和乙的两种溶液仍然是饱和溶液 |
2.关于过氧化物的叙述正确的是(NA表示阿伏加德罗常数)( )
| A. | 7.8g过氧化钠含有的共用电子对数为0.2NA | |
| B. | 2H2O2(l)=2H2O(l)+O2(g)△H=-98.2kJ•mol-1,△S=70.5J•mol-1•K-1该反应任意温度下都能自发进行 | |
| C. | 过氧化氢使高锰酸钾溶液褪色,1mol过氧化氢得到2NA电子 | |
| D. | 在含有NH4+、Ba2+、Cl-、NO3-离子的溶液中,加入少量过氧化钠以上各离子量几乎不减少 |
9.“酸化”是实验中经常采用的方法,下列说法正确的是( )
| A. | 提高高锰酸钾的氧化能力,用浓盐酸酸化 | |
| B. | 抑制Fe2+ 的水解,用稀硝酸酸化 | |
| C. | 检验某卤代烃中是否含氯元素,先加HNO3酸化,再加AgNO3溶液检验. | |
| D. | 确认溶液中含有SO42- 时,先用过量盐酸酸化,再加BaCl2溶液检验. |
19.下列物质不属于电解质的是( )
| A. | BaCl2 | B. | KOH | C. | HNO3 | D. | C2H5OH |
3.若某ⅡB族元素原子序数为x,那么原子序数为x+1的元素位于( )
| A. | ⅢA族 | B. | ⅢB族 | C. | ⅠB族 | D. | 0族 |
4.在“绿色化学”工艺中,理想状态是反应物中的原子全能转化目标产物,即原子利用率为100%.在下列反应类型中,不能体现这一原子最经济性原则的是( )
| A. | 化合反应 | B. | 消去反应 | C. | 加成反应 | D. | 加聚反应 |
 以下是生活中常见的物品:a.玻璃杯 b.电源插座 c.废旧干电池 d.废报纸 e.尼龙绳 f.轮胎 g.铁锅
以下是生活中常见的物品:a.玻璃杯 b.电源插座 c.废旧干电池 d.废报纸 e.尼龙绳 f.轮胎 g.铁锅