题目内容
6. 以下是生活中常见的物品:a.玻璃杯 b.电源插座 c.废旧干电池 d.废报纸 e.尼龙绳 f.轮胎 g.铁锅
以下是生活中常见的物品:a.玻璃杯 b.电源插座 c.废旧干电池 d.废报纸 e.尼龙绳 f.轮胎 g.铁锅请用相应的字母填空:
①用无机非金属材料制作的是a.
②用合成高分子材料中橡胶制作的是f.
③随意丢弃会对水体和土壤都造成污染的是c.
④如图所示,物品d可投入A(填“A”或“B”)标志的垃圾桶中.
分析 a.玻璃杯的主要成分为硅酸盐,属于无机非金属材料;
b.电源插座主要成分为酚醛树脂,属于塑料;
c.废旧干电池中含有重金属元素汞等,有毒,随意丢弃能够污染水和土壤;
d.废报纸主要成分为纤维素,可循环利用;
e.尼龙绳主要成分为合成纤维,属于高分子材料;
f.轮胎主要成分为橡胶,属于合成高分子材料;
g.铁锅主要成分为铁,属于金属材料,可回收利用.
解答 解:①a.玻璃杯主要成分为硅酸盐,属于无机非金属材料;
故选:a;
②轮胎主要成分为橡胶,属于合成高分子材料;
故选:f;
③废旧干电池中含有重金属元素汞等,有毒,随意丢弃能够污染水和土壤;
故选:c;
④废报纸主要成分为纤维素,可循环利用;
故选:A.
点评 本题考查了生活中常见的材料及其分类,熟悉材料的成分是解题关键,注意废旧材料的处理方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.咖啡酸具有止血功效,存在于多种中药中,其结构简式如图:则下列有关说法正确的是( )
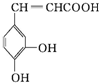

| A. | 该物质中苯环上一氯代物有2种 | |
| B. | 该分子结构中含有两种官能团 | |
| C. | 既能发生取代反应,也能发生加成反应 | |
| D. | 所有碳原子不可能都在同一个平面上 |
11.下列属于共价化合物的是( )
| A. | Cl2 | B. | NaOH | C. | CH4 | D. | (NH4)2SO4 |
18.下列给出14种元素的电负性:
请运用元素周期律知识完成下列各题.
(1)同一周期中,从左到右,元素的电负性逐渐增大;同一主族中,从上到下,元素的电负性逐渐减小.所以,元素的电负性随原子序数的递增呈周期性变化.
(2)短周期元素中,由电负性最大的元素与电负性最小的元素形成的化合物的化学式为NaF,用电子式表示该化合物的形成过程: .
.
(3)表中符合“对角线规则”的元素有Li和Na、Be和Mg、B和Al,它们的性质分别有一定的相似性,其原因是处对角线上,写出Be(OH)2与强酸及强碱反应的离子方程式:Be(OH)2+2OH-=BeO22-+2H2O;.
(4)一般认为,两成键元素间电负性差值大于1.7时形成离子键,两成键元素间电负性差值小于1.7时,形成共价键.判断Mg3N2、SO2、AlCl3、CS2、MgO是离子化合物还是共价化合物.
离子化合物Mg3N2、MgO、共价化合物SO2、AlCl3、CS2.
| 元素 | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
(1)同一周期中,从左到右,元素的电负性逐渐增大;同一主族中,从上到下,元素的电负性逐渐减小.所以,元素的电负性随原子序数的递增呈周期性变化.
(2)短周期元素中,由电负性最大的元素与电负性最小的元素形成的化合物的化学式为NaF,用电子式表示该化合物的形成过程:
 .
.(3)表中符合“对角线规则”的元素有Li和Na、Be和Mg、B和Al,它们的性质分别有一定的相似性,其原因是处对角线上,写出Be(OH)2与强酸及强碱反应的离子方程式:Be(OH)2+2OH-=BeO22-+2H2O;.
(4)一般认为,两成键元素间电负性差值大于1.7时形成离子键,两成键元素间电负性差值小于1.7时,形成共价键.判断Mg3N2、SO2、AlCl3、CS2、MgO是离子化合物还是共价化合物.
离子化合物Mg3N2、MgO、共价化合物SO2、AlCl3、CS2.
15.某烃1mol最多能和2mol HCl加成,生成氯代烃,此氯代烃l mol能和6mol Cl2发生取代反应,生成物中只有碳氯两种元素,此烃为( )
| A. | C2H2 | B. | C2H4 | C. | C3H4 | D. | C4H6 |