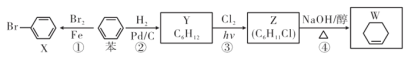
题目内容
【题目】用氟硅酸(H2SiF6)制备冰晶石(Na3AlF6)的工艺流程如图所示:
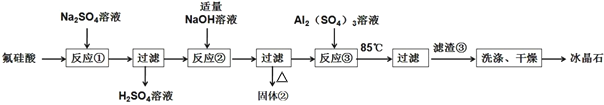
已知:冰晶石(Na3AlF6)微溶于水。
(1)工业上采用电解氧化铝-冰晶石熔融体的方法冶炼金属铝,加入冰晶石的作用是_____。
(2)已知氟硅酸(H2SiF6)酸性强于硫酸,写出反应①的化学方程式______。
(3)反应②为脱硅工艺,固体②是_____。
(4)向NaF溶液中加入Al2(SO4)3溶液发生反应③的离子方程式为_____;NaF溶液呈碱性,在加入Al2(SO4)3溶液前,需先用硫酸将NaF溶液的pH下调至5左右,否则可能产生副产物_____。
(5)干燥前,检验冰晶石是否洗涤干净的实验方法是_____。
(6)从母液中可循环利用的物质是_____。
【答案】降低氧化铝的熔融温度 H2SiF6+Na2SO4=Na2SiF6↓+H2SO4 SiO2 6F-+Al3++3Na+=Na3AlF6↓ Al(OH)3 取最后一次滤液置于小试管中,向其中加入BaCl2溶液,若无沉淀,则已洗涤干净,否则没有洗涤干净 Na2SO4
【解析】
(1)工业上采用电解氧化铝-冰晶石熔融体的方法冶炼金属铝,加入冰晶石的作用是降低氧化铝的熔融温度,节省能源。
(2)氟硅酸(H2SiF6)酸性强于硫酸,反应①的原理是强酸制弱酸。
(3)反应②为脱硅工艺,其发生反应的方程式为Na2SiF6+4NaOH=SiO2+6NaF+2H2O,由此可得固体②的成分。
(4)向NaF溶液中加入Al2(SO4)3溶液发生反应③,从图中可以看出,F-、Al3+、Na+反应生成Na3AlF6,且其为难溶物;NaF溶液呈碱性,在加入Al2(SO4)3溶液前,需先用硫酸将NaF溶液的pH下调至5左右,否则Al3+会发生水解。
(5)干燥前,若冰晶石未洗涤干净,则其表现会附着溶液中的离子,应检验洗涤液中是否含有SO42-。
(6)从母液为Na2SO4溶液,而反应中②也需要加入Na2SO4,所以其可循环利用。
(1)工业上采用电解氧化铝-冰晶石熔融体的方法冶炼金属铝,加入冰晶石的作用是降低氧化铝的熔融温度,节省能源。答案为:降低氧化铝的熔融温度;
(2)氟硅酸(H2SiF6)酸性强于硫酸,反应①的原理是强酸制弱酸,反应①的化学方程式为H2SiF6+Na2SO4=Na2SiF6↓+H2SO4。答案为H2SiF6+Na2SO4=Na2SiF6↓+H2SO4;
(3)反应②为脱硅工艺,其发生反应的方程式为Na2SiF6+4NaOH=SiO2+6NaF+2H2O,由此可得固体②的成分为SiO2。答案为:SiO2;
(4)向NaF溶液中加入Al2(SO4)3溶液发生反应③,从图中可以看出,F-、Al3+、Na+反应生成Na3AlF6,且其为难溶物,反应③的离子方程式为6F-+Al3++3Na+=Na3AlF6↓;NaF溶液呈碱性,在加入Al2(SO4)3溶液前,需先用硫酸将NaF溶液的pH下调至5左右,否则Al3+会发生水解,可能产生的副产物为Al(OH)3。答案为:6F-+Al3++3Na+=Na3AlF6↓;Al(OH)3;
(5)干燥前,若冰晶石未洗涤干净,则其表现会附着溶液中的离子,应检验洗涤液中是否含有SO42-。答案为:取最后一次滤液置于小试管中,向其中加入BaCl2溶液,若无沉淀,则已洗涤干净,否则没有洗涤干净;
(6)从母液为Na2SO4溶液,而反应中②也需要加入Na2SO4,所以其可循环利用。答案为:Na2SO4。

【题目】A、B、C、D、E、F、G、H八种主族元素分布在三个不同的短周期,它们在周期表中位置如下:
A | ||||||
B | C[ | D | ||||
E | F | G | H | |||
请回答下列问题:
(1)写出E元素在周期表中的位置 。
(2)B与D可形成三原子分子X,X的电子式为 。
(3)E、F、H所形成的简单离子的半径由大到小的顺序为 (用离子符号表示)。
(4)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
(5)由A、C、D三种元素组成的强电解质Z溶于水时能促进水的电离,测得Z的水溶液pH<7,其原因是 (用离子方程式来表示)。
(6)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如图所示。
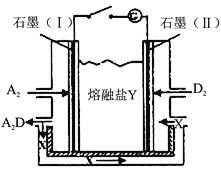
写出石墨(I)电极上发生的电极反应式 。
(7)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为 。