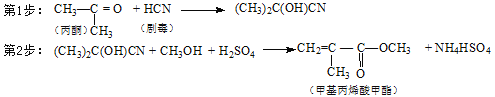��Ŀ����
����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��еĢ١�����10��Ԫ����Ԫ�ط��Ż�ѧʽ��ջش��������⣺

����д���пհף�
��1���ǽ�������ǿ��Ԫ����___________����Ԫ�ط��ţ���
��2��д��������γ�ԭ�Ӹ�����Ϊ1:1������ĵ���ʽ��____________���û����������������������ط�Ӧ�����ӷ���ʽ��__________________________
��3������������Ӧ��ˮ�����м�����ǿ����_______���ѧʽ����д����������ߵ�����������Ӧ��ˮ���ﷴӦ�����ӷ���ʽΪ��____________��
��4���ɢ٢ڢۢ�����Ԫ���е�������ɵ�һ��ǿ�ᣬ��ǿ���ϡ��Һ��ͭ��Ӧ�����ӷ���ʽ ____________________________
������������Ԫ����ɵ����ʼ䣬��һ�������£����Է�����ͼ�еı仯������A��һ�ֵ���ɫ���壬����������,X��һ���⻯��,������ΪҺ�塣��

��1��A��Һ��X��Ӧ�Ļ�ѧ����ʽ��____________________________��
��2������Y��һ�ִ�����Ⱦ���ɫ���д̼�����ζ�����壬ֱ���ŷŻ��γ����ꡣд������Y����ˮ��Ӧ�����ӷ���ʽ��___________________________��
��3����100 mL 18 mol/L��FŨ��Һ�м������ͭƬ������ʹ֮��ַ�Ӧ��������������Ϊ11.2 L������£�����Ӧ������ת�Ƶĵ�����Ϊ__________(�á�NA����ʾ)
���𰸡� F ![]() 5H2O2 + 2MnO4- + 6H+ == 2Mn2+ + 8H2O + 5O2�� NaOH Al(OH)3+OH��=AlO2��+2H2O 3Cu+2NO3-+8H+��3Cu2++2NO��+4H2O 2Na2O2+2H2O��4NaOH+O2�� Cl+SO+ 2HO�� 4H+SO��+2Cl�� NA
5H2O2 + 2MnO4- + 6H+ == 2Mn2+ + 8H2O + 5O2�� NaOH Al(OH)3+OH��=AlO2��+2H2O 3Cu+2NO3-+8H+��3Cu2++2NO��+4H2O 2Na2O2+2H2O��4NaOH+O2�� Cl+SO+ 2HO�� 4H+SO��+2Cl�� NA
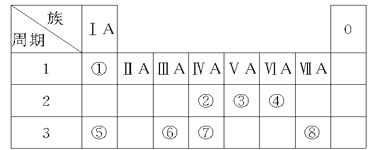
������������Ԫ�������ڱ��е�λ��֪���٢ڢۢܢݢޢߢ���ֱ���H��N��O��F��Na��Mg��Al��Si��P��SԪ�أ�
������1������Ԫ�������ɣ�ͬ���ڴ�������Ԫ�طǽ����������ӣ�ͬ�����������Ԫ�ؽ����������ӣ�����������Ԫ���У��ǽ�������ǿ��Ԫ����F����
��2��H��O�γ�ԭ�Ӹ�����Ϊ1:1�Ļ�����ΪH2O2�������ʽΪ![]() ���û��������������±����������������������������Ӧ�����ӷ���ʽΪ5H2O2 + 2MnO4- + 6H+ == 2Mn2+ + 8H2O + 5O2����
���û��������������±����������������������������Ӧ�����ӷ���ʽΪ5H2O2 + 2MnO4- + 6H+ == 2Mn2+ + 8H2O + 5O2����
��3��Ԫ�ؽ�����Խǿ������������Ӧ��ˮ�����м���Խǿ������������Ԫ�ض�Ӧ�������У��������Ƶļ�����ǿ����ѧʽΪNaOH���ߵ�����������Ӧ��ˮ����Ϊ������������������������������Ӧ����ƫ�����ƣ���Ӧ�����ӷ���ʽΪAl��OH��3+OH-=AlO2-+2H2O����
��4����H��N��O��S����Ԫ���е�������ɵ�һ��ǿ����HNO3��H2SO4����ֻ��ϡ��������ͭ��Ӧ��������ͭ��NO��ˮ��������Ӧ�����ӷ���ʽ 3Cu+2NO3-+8H+��3Cu2++2NO��+4H2O ��
��������������Ԫ����ɵ����ʣ�A��һ�ֵ���ɫ���壬��������������AΪ�������ƣ�X��һ���⻯�������ΪҺ�壬��XΪˮ����BΪ�������ƣ�CΪ����������Y��һ�ִ�����Ⱦ���ɫ���д̼�����ζ�ģ�ֱ���ŷŻ��γ����꣬������B��Ӧ����YΪ������������DΪ�������ƣ��������������Ӧ����EΪ������������������ˮ��Ӧ����FΪ���ᣬ
��1������������ˮ��Ӧ����NaOH���������˷�Ӧ�Ļ�ѧ����ʽΪ 2Na2O2+2H2O��4NaOH+O2����
��2������Y��SO2���ܱ���ˮ����Ϊ���ᣬͬʱ�õ�ϡ���ᣬ������Ӧ�����ӷ���ʽΪCl+ SO+ 2HO�� 4H+SO��+2Cl����
��3��FΪ���ᣬ��100mL 18mol/L��FŨ��Һ�м������ͭƬ������ʹ֮��ַ�Ӧ��ͭ��Ũ���ᷴӦ���ɶ��������ݵ��ӵ�ʧ�غ��֪��ÿ����1mol��������ת��2mol���ӣ�������������������Ϊ11.2L������£�����Ϊ0.5molʱ����Ӧ������ת�Ƶĵ�����ΪNA ��6.02��1023����