题目内容
【题目】亚氯酸钠(NaClO2)是重要的漂白剂。某小组开展如下实验,按如图装置制取无水NaClO2晶体,回答下列问题:
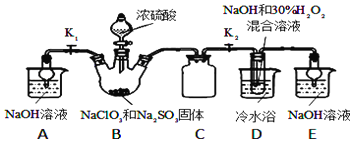
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.
(1)装置C的作用是_________________;
(2)已知装置B中的产物有ClO2气体,则B中反应的方程式为_________________;装置D中反应生成NaClO2的化学方程式为_________________________;
(3)从装置D反应后的溶液中获得无水NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②____________;③用38℃~60℃热水________;④在_____________条件下干燥得到成品.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是_________和____________;
(5)测定样品中NaClO2的纯度.测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+4I-+4H+═2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液.取25.00mL待测溶液,加入淀粉溶液做指示剂,用c molL-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2S2O32-═2I-+S4O62-).请计算所称取的样品中NaClO2的物质的量为__________.
【答案】(1)防止D瓶溶液倒吸到B瓶中(2)2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O
2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2(3)趁热过滤 洗涤 低于60℃(4)NaClO3 NaCl (5) cV10﹣3mol 。
【解析】
(1)装置D中发生气体反应,装置内压强降低,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中;
(2)装置B中制备得到ClO2,所以B中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4;
装置D反应后的溶液获得NaClO2晶体,装置D中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平后方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO23H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥;
(4)由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl,所以如果撤去D中的冷水浴,可能导致产品中混有的杂质是NaClO3和NaCl;
(5)令样品中NaClO2的物质的量x,
NaClO2~2I2~4S2O32-,
1mol 4mol
0.25x c molL-1×V×10-3L
则:x=cV10-3mol
故答案为cV10-3mol;