题目内容
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
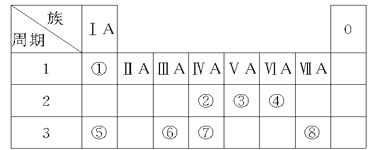
(1)④、⑤、⑥的原子半径由大到小的顺序为(填元素符号)_______。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式)________。
(3)①、④、⑤三种元素可形成既含离子键又含共价键的化合物,写出该化合物的电子式________。
(4)②的氧化物的结构式_________;比较②、⑦的氧化物的熔点(填化学式):
______>_______,原因是___________________________________________。
(5)根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。
①Be(OH)2与Mg(OH)2可用__________鉴别(填名称)。
②写出Be与NaOH溶液反应生成Na2BeO2的离子方程式:_________________________。
【答案】 Na>Al>O HNO3>H2CO3>H2SiO3(或H4SiO4) ![]() O=C=O SiO2 CO2 二氧化碳形成分子晶体,二氧化硅是原子晶体 氢氧化钠溶液 Be+2OH-===BeO
O=C=O SiO2 CO2 二氧化碳形成分子晶体,二氧化硅是原子晶体 氢氧化钠溶液 Be+2OH-===BeO![]() +H2↑
+H2↑
【解析】参照元素①~⑧在表中的位置可知分别是H、C、N、O、Na、Al、Si、Cl。则
(1)同周期自左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则④、⑤、⑥的原子半径由大到小的顺序为 Na>Al>O。(2)非金属性是N>C>Si,非金属性越强,最高价含氧酸的酸性越强,则②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3(或H4SiO4)。(3)①、④、⑤三种元素可形成既含离子键又含共价键的化合物是氢氧化钠,电子式为![]() 。(4)②的氧化物是CO2,结构式为 O=C=O;二氧化碳形成分子晶体,二氧化硅是原子晶体,属于CO2的熔点低于二氧化硅。(5)根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。①Be(OH)2是两性氢氧化物,因此与Mg(OH)2可用氢氧化钠溶液鉴别。②Be与NaOH溶液反应生成Na2BeO2的离子方程式为Be+2OH-=BeO22-+H2↑。
。(4)②的氧化物是CO2,结构式为 O=C=O;二氧化碳形成分子晶体,二氧化硅是原子晶体,属于CO2的熔点低于二氧化硅。(5)根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。①Be(OH)2是两性氢氧化物,因此与Mg(OH)2可用氢氧化钠溶液鉴别。②Be与NaOH溶液反应生成Na2BeO2的离子方程式为Be+2OH-=BeO22-+H2↑。

 阅读快车系列答案
阅读快车系列答案【题目】下列物质除杂(括号内物质为杂质)所用试剂正确的是( )
物 质 | 试 剂 | |
A | Na2SO4溶液(NaBr) | Cl2 |
B | KNO3(NaCl) | AgNO3溶液 |
C | Cl2(HCl) | 饱和食盐水 |
D | CO2(HCl) | 饱和Na2CO3溶液 |
A.A
B.B
C.C
D.D