题目内容
【题目】下列物质①HCl②CO2③H2O④H2⑤NaHSO4⑥Cl2⑦NaF⑧CH4⑨CaO⑩MgCl2
(1)属于离子化合物的是_______,只含共价键的是______,既含有离子键又有共价键的是______。
(2)属于电解质的是__________,属于非电解质的是___________。
(3)将NaHSO4熔化,破坏了NaHSO4中的__________键,写出其电离方程式_____________。将NaHSO4溶于水,破坏了NaHSO4中的_________键,写出其电离方程式_____________。
(4)分别用电子式表示氯化镁、氯气的形成过程:____________。
【答案】(1)⑤⑦⑨⑩;①②③④⑥⑧;⑤
(2)①③⑤⑦⑨⑩;②⑧
(3)离子;NaHSO4=Na++HSO4-;离子键和共价键;NaHSO4=Na++H++SO42-
(4)![]() ;
;![]()
【解析】
试题分析:①HCl分子中只含有共价键,属于共价化合物;在水中能完全电离出自由移动的阴阳离子,属于强电解质;②CO2分子中只含有共价键,属于共价化合物;在水中自身不能电离出自由移动的阴阳离子,属于非电解质;③H2O分子中只含有共价键,属于共价化合物;能发生微弱的电离生成氢离子和氢氧根离子,属于弱电解质;④H2分子中只含有共价键,属于单质,所以既不是电解质也不是非电解质;⑤NaHSO4中钠离子和硫酸氢根离子间存在离子键、硫酸氢根离子内存在极性共价键,属于离子化合物;在水中及融化状态下均能完全电离出自由移动的阴阳离子,属于强电解质;⑥Cl2分子中只含有共价键,属于单质,所以既不是电解质也不是非电解质;⑦NaF中钠离子和氟离子间只存在离子键、属于离子化合物;在水中及融化状态下均能完全电离出自由移动的阴阳离子,属于强电解质;⑧CH4分子中只含有共价键,属于共价化合物;在水中自身不能电离出自由移动的阴阳离子,属于非电解质;⑨CaO中钠离子和氧离子间只存在离子键、属于离子化合物;在融化状态下能完全电离出自由移动的阴阳离子,属于强电解质;⑩MgCl2中镁离子和氯离子间只存在离子键、属于离子化合物;在水中及融化状态下均能完全电离出自由移动的阴阳离子,属于强电解质。据此可得下列结论:
(1)属于离子化合物的是⑤⑦⑨⑩,只含共价键的是①②③④⑥⑧,既含有离子键又有共价键的是⑤。
(2)属于电解质的是①③⑤⑦⑨⑩,属于非电解质的是②⑧。
(3)将NaHSO4熔化,破坏了NaHSO4中的离子键,其电离方程式为:NaHSO4=Na++HSO4-。将NaHSO4溶于水,破坏了NaHSO4中的离子键和部分共价键,其电离方程式为:NaHSO4=Na++H++SO42-。
(4)镁是活泼的金属元素、氯是活泼的非金属元素,二者发生反应过程中进行电子得失生成离子化合物氯化镁,其形成过程可表示为:![]() ;两个氯原子通过共价键形成氯气分子,其形成过程可表示为:
;两个氯原子通过共价键形成氯气分子,其形成过程可表示为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】将物质X逐渐加入(或滴入)Y溶液中,其生成沉淀的物质的量与加入X的物质的量关系如图所示,符合图示情况的是( )
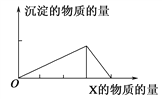
A | B | C | D | |
X | NaOH | HCl | CO2 | AlCl3 |
Y | AlCl3 | NaAlO2 | Ca(OH)2 | NaOH |
A. A B. B C. C D. D



