题目内容
最近几年我国已加大对氮氧化物排放的控制力度。消除氮氧化物污染有多种方法。
(l)用CH4还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
②CH4(g)+4NO (g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
③H2O(g)= H2O(l) △H=-44.0kJ·mol-1
CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式为 。
(2)用活性炭还原法也可处理氮氧化物。有关反应为:2C(s)+2NO2(g)=N2(g)+2CO2(g) △H<0,起始时向密闭容器中充入一定量的C(s)和NO2(g),在不同条件下,测得各物质的浓度变化状况如下图所示。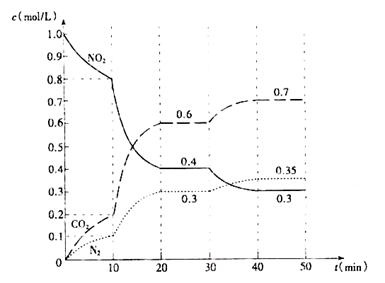
①0?10min内,以CO2表示的平均反应速率v(CO2)= 。
②0~10min,10?20 min,30?40 min三个阶段NO2的转化率分别为α1、α2、α3,其中最小的为 ,其值是 。
③计算反应达到第一次平衡时的平衡常数K= 。
④第10min时,若只改变了影响反应的一个条件,则改变的条件为 (填选项字母)。
A.增加C(s)的量 B.减小容器体积 C.加入催化剂
⑤20~30min、40?50 min时体系的温度分别为T1和T2,则T1_____T2(填“> “<”或“=”), 判断的理由是 。
(1)CH4(g ) +2NO2 ( g ) =N2 ( g )+ CO2 (g ) +2H2O (l ) ΔH= -955 kJ /mol (2分,只要有错该空即不能得分。)
(2)①0.02 mol/(L· min) (2分,数值、单位各1分)
②α1 (1分) 20% (2分)
③ 0.675 (2分,不写单位不扣分,写错单位扣1分)
④ C (2分)
⑤ > (1分) 此反应为放热反应,降低温度,平衡向正反应方向移动(2分,平衡正向移动、该反应为放热反应两个给分点,各1分。)
解析试题分析:(1)根据盖斯定律,方程式①+②-③×4可得目标方程式,反应热作相应变化即可。
(2)①根据图像,10min时CO2的浓度为0.2mol/L,则以CO2表示的反应速率为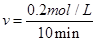 =0.02mol/(L·min)。
=0.02mol/(L·min)。
②根据图像,0~10min内,NO2的转化率α1=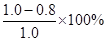 =20%
=20%
10~20min内,NO2的转化率α2=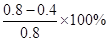 =50%
=50%
30~40min内,NO2的转化率α3=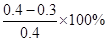 =25%
=25%
③反应在20min时达到平衡,根据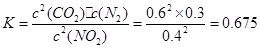 。
。
④根据图像,10~20min内反应速率加快,平衡仍正向移动。增加固体C不影响反应速率,A错;减小容器体积,则增大压强,平衡逆向移动,B错;加入催化剂可加快反应速率,但不影响平衡,C正确。
⑤20~30min、40?50 min是体系的两个平衡状态,由题意可知改变温度使平衡发生移动,40?50 min时的平衡与20~30min时的平衡相比,平衡正向移动,因反应是放热反应,故降低温度平衡正向移动,T1>T2。
考点:考查盖斯定律,热化学方程式书写,图像分析,反应速率计算,转化率计算,化学平衡常数计算,影响化学平衡和化学反应速率因素。

已知反应:3I-(aq)+S2O82-(aq)  I3-(aq)+2SO42-(aq)+Q
I3-(aq)+2SO42-(aq)+Q
(1)写出反应的平衡常数表达式:K= 。
(2)如图表示反应过程中有关物质的能量,则反应过程中的Q 0(填>、<、=);(I)、(II)两曲线中,使用催化剂的是 曲线。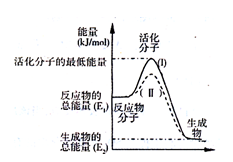
(3)反应的速率可以用I3-与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大。下表是在20℃进行实验时所记录的数据
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol·L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-)/mol·L-1 | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
从表中数据分析,该实验的目的是 ;
表中显色时间t1= s;最终得出的结论是 。
氢气的制取与储存是氢能源利用领域的研究热点。
(1)已知: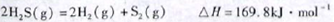
下列有关该反应的叙述正确的是
| A.正反应活化能小于169.8kJ·mol-1 |
| B.逆反应活化能一定小于169.8kJ·mol-1 |
| C.正反应活化能不小于169.8kJ·mol-1 |
| D.正反应活化能比逆反应活化能小169.8kJ·mol-1 |
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系,如图1所示。在4000℃~5000℃时可能发生下列哪些反应 (填写字母)。
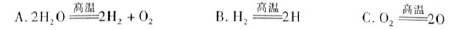
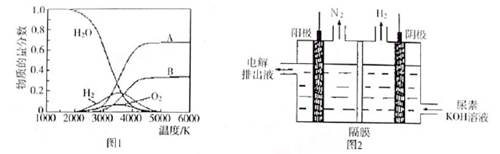
(4)制取氢气的另一种方法是电解尿素[CO(NH2)2]的碱性溶液,装置示意图见图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。该电解装置中电解排出液中的主要成分是 (写化学式)。
(5)已知下列物质的KSP:
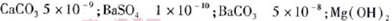
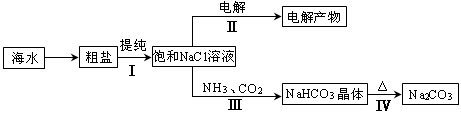
5.6×10-12;Ca(OH)2;1.4×10-5。氯碱工业中 电解饱和食盐水也能得到氢气,电解所用的盐水需精制,去除有影响的Ca2+、Mg2+、NH4+、SO42—[c(SO42—)>c(Ca2+)]。某精制流程如下:
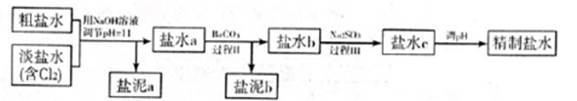
①盐泥a除泥沙外,还含有的物质是 。
②过程I中将NH4+转化为N2的离子方程式是 。
③过程II中除去的离子有 。
④经过程III处理,需求盐水c中剩余Na2SO3的含量小于5mg/L。若盐水b中NaClO的含量是7.45mg/L,则处理10m3盐水b,至多添加10%Na2SO3溶液 kg(溶液体积变化忽略不计)
甲烷和氨在国民经济中占有重要地位。
(1)制备合成氨原料气H2,可用甲烷蒸汽转化法,主要转化反应如下:
CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH =" +206.2" kJ/mol
CO(g) + 3H2(g) ΔH =" +206.2" kJ/mol
CH4(g) + 2H2O(g)  CO2(g) +4H2(g) ΔH = +165.0kJ/mol
CO2(g) +4H2(g) ΔH = +165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是 。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
① 反应热ΔH(填“>”、“<”或“=”)_______0。
② 在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
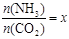 ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。求图中的B点处,NH3的平衡转化率。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。求图中的B点处,NH3的平衡转化率。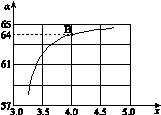
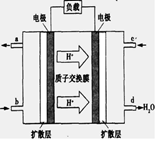
(3)已知甲烷燃料电池的工作原理如下图所示。该电池工作时,a口放出的物质为_________,该电池正极的电极反应式为:____ ,工作一段时间后,当3.2g甲烷完全反应生成CO2时,有 mol 电子发生转移。

 2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
