题目内容
甲烷和氨在国民经济中占有重要地位。
(1)制备合成氨原料气H2,可用甲烷蒸汽转化法,主要转化反应如下:
CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH =" +206.2" kJ/mol
CO(g) + 3H2(g) ΔH =" +206.2" kJ/mol
CH4(g) + 2H2O(g)  CO2(g) +4H2(g) ΔH = +165.0kJ/mol
CO2(g) +4H2(g) ΔH = +165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是 。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
① 反应热ΔH(填“>”、“<”或“=”)_______0。
② 在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
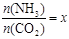 ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。求图中的B点处,NH3的平衡转化率。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。求图中的B点处,NH3的平衡转化率。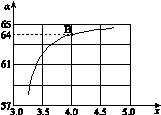
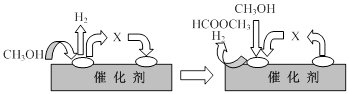
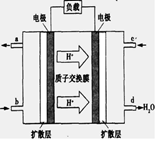
(3)已知甲烷燃料电池的工作原理如下图所示。该电池工作时,a口放出的物质为_________,该电池正极的电极反应式为:____ ,工作一段时间后,当3.2g甲烷完全反应生成CO2时,有 mol 电子发生转移。
(16分)
(1)CO(g)+H2O(g)  CO2(g)+H2(g) ΔH = -41.2 kJ/mol (3分)
CO2(g)+H2(g) ΔH = -41.2 kJ/mol (3分)
(2)① < (2分)
②32% (计算过程见解析)
(3)CO2(2分) O2+4e-+4H+=2H2O(2分) 1.6 (2分)
解析试题分析:(1)先对已知热化学方程式编号为①②,观察发现②—①可得,CO(g)+H2O(g)  CO2(g)+H2(g),其焓变=②的焓变—①的焓变=ΔH = -41.2 kJ/mol,由此可得一氧化碳交换反应的热化学方程式为CO(g)+H2O(g)
CO2(g)+H2(g),其焓变=②的焓变—①的焓变=ΔH = -41.2 kJ/mol,由此可得一氧化碳交换反应的热化学方程式为CO(g)+H2O(g)  CO2(g)+H2(g) ΔH = -41.2 kJ/mol;(2)①读表格中信息可得,随着温度的升高,该反应的平衡常数逐渐减小,根据平衡移动原理和平衡常数计算表达式可知,升高温度平衡向吸热方向移动,平衡常数减小时平衡向逆反应方向移动,因此逆反应是吸热反应,正反应是放热反应,正反应的反应热△H<0;B点的横坐标为4.0,纵坐标为64%,依题意可知n(NH3)/n(CO2)=4.0,CO2的平衡转化率为64%,设起始时CO2的物质的量为1mol,则NH3的物质的量为4.0mol,CO2的变化物质的量为0.64mol,则:
CO2(g)+H2(g) ΔH = -41.2 kJ/mol;(2)①读表格中信息可得,随着温度的升高,该反应的平衡常数逐渐减小,根据平衡移动原理和平衡常数计算表达式可知,升高温度平衡向吸热方向移动,平衡常数减小时平衡向逆反应方向移动,因此逆反应是吸热反应,正反应是放热反应,正反应的反应热△H<0;B点的横坐标为4.0,纵坐标为64%,依题意可知n(NH3)/n(CO2)=4.0,CO2的平衡转化率为64%,设起始时CO2的物质的量为1mol,则NH3的物质的量为4.0mol,CO2的变化物质的量为0.64mol,则:
2NH3(g) + CO2(g)  CO(NH2)2(l) + H2O(l)
CO(NH2)2(l) + H2O(l)
起始物质的量(mol) 4.0 1.0
变化物质的量(mol) 1.28 0.64
平衡物质的量(mol) 2.72 0.36
则NH3的平衡转化率:α(NH3)= 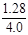 ×100% = 32%
×100% = 32%
(3)燃料电池工作时,内电路中氢离子从负极向正极移动,观察甲烷酸性燃料电池装置图可知,左边电极为负极,右边电极为正极,甲烷在负极上发生氧化反应,生成的二氧化碳气体难溶于酸性电解质溶液,则a口放出的物质是二氧化碳气体;氧气在正极上发生还原反应,根据电子、电荷、原子守恒原理可得:O2+4e—+4H+=2H2O (注意不能写成O2+4e—+2H2O=4OH—,因为酸性电解质溶液中不能大量存在氢氧根离子);由于甲烷的相对分子质量为16,则3.2g甲烷的物质的量为0.2mol,负极反应式为CH4—8e—+2H2O=CO2+8H+,其中转移电子与甲烷的系数之比等于物质的量之比,则转移电子的物质的量为1.6mol。
考点:考查化学反应原理,涉及盖斯定律、热化学方程式的书写、温度对平衡移动的影响、平衡常数与反应热的关系、平衡转化率的计算、甲烷酸性染料电池的 电极产物、正极反应式、甲烷质量与转移电子的物质的量的计算等。

常温下钛的化学活性很小,在较高温度下可与多种物质反应。
(1)工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下: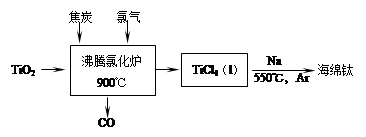
① 沸腾氯化炉中发生的主要反应为: 。
②已知:Ti(s) +2Cl2(g)=TiCl4(l) ΔH=a kJ·mol-1;
2Na(s) +Cl2(g)=2NaCl(s) ΔH=b kJ·mol-1;
Na(s)=Na(l) ΔH=c kJ·mol-1;
则TiCl4(l) +4Na(l)=Ti(s) +4NaCl(s) ΔH= kJ·mol-1。
③ TiCl4遇水强烈水解,写出其水解的化学方程式 。
(2)TiO2直接电解法生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如图所示,二氧化钛电极连接电 极,该极电极反应为: 。但此法会产生有毒气体,为减少对环境的污染,在电池中加入固体氧离子隔膜(氧离子能顺利通过),将两极产物隔开,再将石墨改为金属陶瓷电极,并通入一种还原性气体,该气体是 。
(3)海绵钛可用碘提纯,原理为: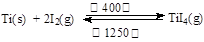 ,下列说法正确的是 。
,下列说法正确的是 。
| A.该反应正反应的ΔH>0 |
| B.在不同温度区域,TiI4的量保持不变 |
| C.在提纯过程中,I2 的作用是将粗钛从低温区转移到高温区 |
| D.在提纯过程中,I2 可循环利用 |
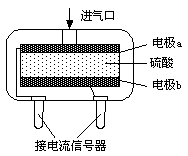
某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液
(1)若实验中大约要使用470 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从图中选择称量NaOH固体所需要的仪器是(填字母): 。
| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  | 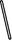 |  |  |
| 序号 | a | b | c | d | e | f |
Ⅱ.测定中和热
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、盐酸、NaOH溶液,尚缺少的实验玻璃用品是 。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | |||
| H2SO4 | NaOH | 平均值 | ||||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | | |
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=“4.18”J/(g·℃)。则中和热ΔH= (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
在一定温度下,容器内某一反应中两种气态物质M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
A.反应的化学方程式为:2M N N |
| B.t2时,正逆反应速率相等,反应达到平衡状态 |
| C.t3时,M上a点正反应速率等于N上b点的逆反应速率 |
D. 混一定时,N的体积百分含量也一定 混一定时,N的体积百分含量也一定 |
对于反应 A + B 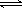 C,下列条件的改变一定能使化学反应加快的是
C,下列条件的改变一定能使化学反应加快的是
| A.升高体系的温度 | B.增加A的物质的量 |
| C.减少C的物质的量 | D.增大体系的压强 |
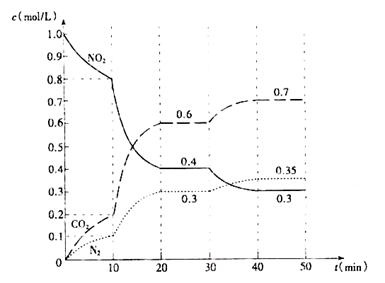
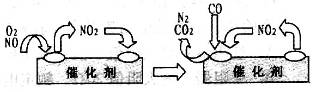 。
。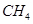 催化还原
催化还原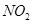 的方法也可以消除氮氧化物的污染。例如:
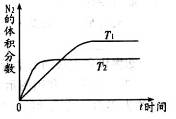
的方法也可以消除氮氧化物的污染。例如: 2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。
2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。
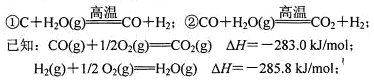
 HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0