题目内容
13.下列变化中既有离子键断裂,又有共价键断裂的是( )| A. | 用NaCl配成一定物质的量浓度溶液 | B. | HCl溶于水 | ||
| C. | 水变成水蒸气 | D. | (NH4)2CO3加强热 |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,有离子键和共价键断裂,说明该物质发生化学反应或发生电离,据此分析解答.
解答 解:A.配制一定物质的量浓度的NaCl溶液,NaCl中只含离子键,氯化钠在水分子的作用下电离出阴阳离子,离子键发生断裂但没有共价键断裂,故A错误;
B.HCl中只含共价键,在水分子的作用下发生共价键电离,故B错误;
C.水变成水蒸气,发生物理变化,只是破坏分子间作用力,化学不被破坏,故C错误;
D.碳酸铵受热分解生成氨气、二氧化碳和水,所以离子键和共价键都发生断裂,故D正确;
故选D.
点评 本题考查化学键的变化,侧重考查分析判断能力,明确物质中存在的化学键及发生的变化是解本题关键,注意有化学键断裂不一定有化学键生成,如电解质溶于水,注意铵盐中都含有离子键,为易错点.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
3.用1mol•L-1的盐酸与锌反应来制取H2,为了加快反应速率,可采取的措施是( )
| A. | 加入相同物质的量浓度的盐酸 | B. | 加入相同物质的量浓度的硝酸 | ||
| C. | 加入相同物质的量浓度的硫酸 | D. | 加入少量的氯化钠溶液 |
1.在无色溶液中下列粒子能大量共存的是( )
| A. | Fe2+、Na+、Cl-、SCN- | B. | Na+、Cu2+、NO3-、Cl- | ||
| C. | Na+、H+、NO3-、SO42- | D. | Al3+、Na+、Cl-、NH3•H2O |
8.下列化学反应中反应物总能量高于生成物物总能量的是( )
| A. | CO2与炭化合 | B. | 碳酸钙分解反应 | C. | 铝热反应 | D. | 制水煤气反应 |
18.下列各组中,顺序排列错误的是( )
| A. | 离子半径:O2->Na+>Mg2+>Al3+>F- | |
| B. | 热稳定性:HCl>H2S>PH3>AsH3 | |
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4<H2SO4 | |
| D. | 碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3 |
2.下列操作中,若以标准溶液滴定待测液,能造成中和滴定结果偏低的是( )
| A. | 未用标准液润洗滴定管 | |
| B. | 盛标准液的滴定管尖嘴部分有气泡未排出就开始滴定,滴定后气泡消失 | |
| C. | 锥形瓶用蒸馏水洗,未用待测液润洗 | |
| D. | 振荡时锥形瓶中液滴飞溅出来 |
3.下列各组化合物中,化学键类型都相同的是( )
| A. | CaCl2和Na2O2 | B. | Na2O和Na2O2 | C. | CO2和CS2 | D. | HCl和NaOH |
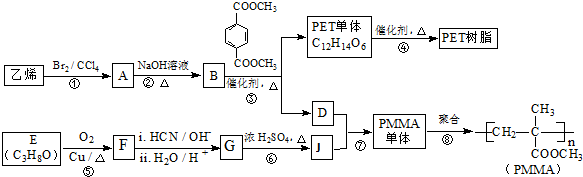 已知:
已知: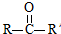 $→_{ii.H_{2}O/H+}^{i.HCN/OH-}$
$→_{ii.H_{2}O/H+}^{i.HCN/OH-}$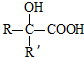 (R、R’代表烃基)
(R、R’代表烃基)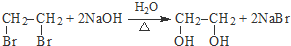 .
.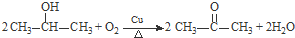 .
.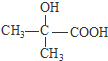 .
.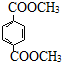 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH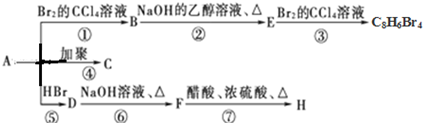
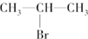 (主要产物)
(主要产物)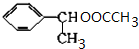 ,
,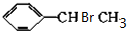 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$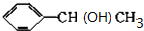 +NaBr.
+NaBr.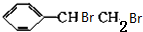 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$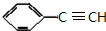 +2NaBr+2H2O
+2NaBr+2H2O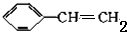 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ .
.