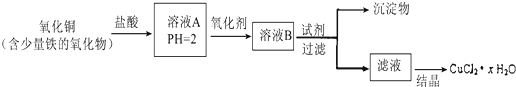
题目内容
7.(1)补充完成表格:(请把序号①-④的答案对应填入横线上)| 元素 | 甲 | 乙 |
| 元素符号 | ①Na | ②Cl |
| 原子结构 示意图 |  | ③ 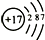 |
| 周期 | 三 | 三 |
| 族 | ④IA | VII A |
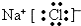 .
.(3)乙元素最高价氧化物对应水化物的化学式为HClO4.
(4)甲单质与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
分析 (1)对于甲:质子数为11,表示Na元素,处于ⅠA;
对于乙:处于第三周期ⅦA族,为Cl元素,原子核外有3个电子层,各层电子数为2、8、7;
(2)金属钠和氯气反应生成氯化钠,氯化钠是钠离子和氯离子之间通过离子键形成的离子化合物;
(3)Cl的最高价氧化物对应水化物是高氯酸;
(4)钠与水反应生成氢氧化钠与氢气.
解答 解:(1)对于甲:质子数为11,表示Na元素,处于ⅠA;
对于乙:处于第三周期ⅦA族,为Cl元素,原子核外有3个电子层,各层电子数为2、8、7,结构示意图为 ,
,
故答案为:①Na;②Cl;③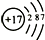 ; ④IA;
; ④IA;
(2)金属钠和氯气反应生成氯化钠,氯化钠是钠离子和氯离子之间通过离子键形成的离子化合物,电子式为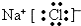 ,故答案为:
,故答案为: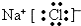 ;
;
(3)对于乙:处于第三周期ⅦA族,为Cl元素,Cl的最高价氧化物对应水化物是高氯酸,即HClO4,故答案为:HClO4;
(4)钠与水反应生成氢氧化钠与氢气,化学方程式为2Na+2H2O=2NaOH+H2↑,故答案为:2Na+2H2O=2NaOH+H2↑.
点评 本题考查结构性质位置关系,比较基础,旨在考查学生对基础知识的理解掌握.

练习册系列答案
相关题目
15.在含有FeCl2的溶液中加入足量下列试剂,然后再加入KSCN溶液,最终不能使溶液呈血红色的是( )
| A. | 稀硝酸 | B. | 铁粉 | C. | 氯水 | D. | 双氧水 |
2.氧族元素的各种性质可归纳整理出如表(部分):
回答下列问题:
(1)S2-的电子式为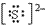 .
.
(2)氧元素比硫元素非金属性强(填强或弱).请用化学方程式证明该结论:2H2S+O2=2S↓+2H2O.
| 元素 性质 | 8O | 16S | Se | 52Te |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1 390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径(nm) | 0.074 | 0.102 | 0.116 | 0.143 |
| 单质与H2反应 | 点燃易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
(1)S2-的电子式为
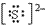 .
.(2)氧元素比硫元素非金属性强(填强或弱).请用化学方程式证明该结论:2H2S+O2=2S↓+2H2O.
12.可与Ba(OH)2(固态)、CuSO4(固态)、纯CH3COOH三种物质归于一类的物质是( )
| A. | C2H5OH(水溶液) | B. | 盐酸 | C. | 水煤气 | D. | 烧碱 |
19.下列关于萃取操作的说法正确的是( )
| A. | 从溴水中提取溴,可加入酒精作萃取剂 | |
| B. | 萃取操作完成后,静置分液,上、下层液体均从下口放出 | |
| C. | 用一种有机溶剂,提取水溶液中的某物质,静置分液后,“水层”应在上层 | |
| D. | 萃取时,所加入的溶剂应与原溶剂互不相溶,且与溶质相互间不反应 |

 (1)为探究外界条件对化学平衡的影响某化学小组设计了如下实验:
(1)为探究外界条件对化学平衡的影响某化学小组设计了如下实验: