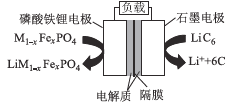
题目内容
【题目】(1)下列关于充电电池、干电池的叙述合理的是___。
①干电池可以实现化学能向电能的转化和电能向化学能的转化
②锌锰干电池长时间连续使用时内装糊状物可能流出腐蚀电器
③充电电池可以无限制地反复放电、充电
④充电是使放电时的氧化还原反应逆向进行
(2)铅蓄电池中,正极材料为PbO2,负极材料为Pb,放电时其负极反应式为___。
(3)原电池在NaOH溶液介质中,铝为负极,其负极反应式为__。
(4)航天技术中使用的氢氧燃料电池具有高能、轻便和无污染等优点。氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式都为2H2+O2=2H2O。
①酸式氢氧燃料电池的电解质溶液是稀硫酸,其负极反应式为2H2-4e-=4H+,则其正极反应式为____。
②碱式氢氧燃料电池的电解质溶液是KOH溶液,则其负极反应式为___。
【答案】②④ Pb+SO![]() -2e-=PbSO4 Al+4OH--3e-=AlO
-2e-=PbSO4 Al+4OH--3e-=AlO![]() +2H2O O2+4H++4e-=2H2O 2H2+4OH--4e-=4H2O
+2H2O O2+4H++4e-=2H2O 2H2+4OH--4e-=4H2O
【解析】
(1)①干电池是一次电池,只能将化学能转变成电能,实现化学能向电能的转化,故错误;
②锌锰干电池长时间连续使用时做为负极的外壳不断被耗损,会出现破损导致内装糊状物可能流出腐蚀电器,故正确;
③充电电池理论上可以无限制地反复放电、充电,但实际反应转化时不能彻底进行,充放电过程都有物质的损失,导致电池有一定的使用寿命,故错误;
④充电是使放电时的反应产物重新转变成反应物,充放电反应是互逆的氧化还原反应,故正确;
故答案为:②④。
(2)铅蓄电池中,负极为Pb,放电时铅失电子变成铅离子,与电解质溶液中的硫酸根结合成硫酸铅,负极反应为:Pb+SO![]() -2e-=PbSO4,故答案为:Pb+SO
-2e-=PbSO4,故答案为:Pb+SO![]() -2e-=PbSO4。
-2e-=PbSO4。
(3)原电池在NaOH溶液介质中,铝为负极,实际反应是铝与氢氧化钠反应转变成偏铝酸钠,负极反应为:Al+4OH--3e-=AlO![]() +2H2O,故答案为:Al+4OH--3e-=AlO
+2H2O,故答案为:Al+4OH--3e-=AlO![]() +2H2O。
+2H2O。
(4)①酸式氢氧燃料电池总反应式为2H2+O2=2H2O,电解质溶液是稀硫酸,其负极反应式为2H2-4e-=4H+,则正极反应式=总反应式-负极反应式,由此可得正极反应式为:O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O。
②碱式氢氧燃料电池的电解质溶液是KOH溶液,则其负极反应式2H2+4OH--4e-=4H2O,故答案为:2H2+4OH--4e-=4H2O。

 字词句段篇系列答案
字词句段篇系列答案【题目】Cr、S等元素的化合物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)还原沉淀法是处理含铬(Cr2O72和CrO42)工业废水的常用方法,过程如下:
![]()
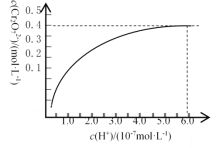
①已知:常温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。则上述流程中CrO42-转化为Cr2O72-的离子方程式为______________________。
②还原过程中氧化剂与还原剂的物质的量之比为__________。
③Cr3+与Al3+的化学性质相似,对CrCl3溶液蒸干并灼烧,最终得到的固体的化学式为____________。
④常温下,Ksp[Cr(OH)3]=1.0×10-32,欲使处理后废水中的c(Cr3+)降至1.0×10-5mol·L1(即沉淀完全),应调节至溶液的pH=_____。
(2)“亚硫酸盐法”吸收烟中的SO2
①将烟气通入1.0mol/L 的Na2SO3溶液,当Na2SO3恰好完全反应时,溶液pH约为3,此时,溶液中各种离子浓度由大到小的顺序为_________(用离子浓度符号和“>”号表示)。
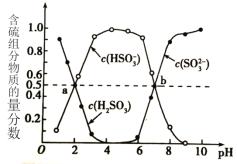
②室温下,将烟道气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示。
已知部分弱电解质的电离常数(25℃)如下:
电解质 | 电离常数 |
H2SO3 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
NH3·H2O | Kb=1.74×10-5 |
(i)(NH4)2SO3溶液呈____(填“酸”、“碱”或“中”)性,其原因是_________________。
(ii)图中b点时溶液pH=7,则n(NH4+):n(HSO3- )=_________。
【题目】(1)如图为某原子3d能级的电子排布情况.
![]()
该排布情况违反了________原理
(2)s电子的原子轨道呈_________形,每个s能级有_________个原子轨道;p电子的原子轨道_________形,每个p能级有_________个原子轨道。
(3)填表
分子或离子 | CO2 | H2O | SO3 | NH4+ | N2O |
VSEPR模型名称 | ____ | _____ | ____ | ____ | _____ |
中心原子杂化轨道类型 | ____ | ____ | ____ | ____ | ____ |
分子或离子立体构型 | ___ | ___ | ___ | ___ | ___ |