题目内容
要准确掌握化学用语及常用计量方法。按要求回答下列问题:
(1)NA表示阿伏加德罗常数。28g乙烯和环丁烷(C4H8)的混合气体中含有____NA个碳原子;分子总数为NA个的NO2和CO2混合气体含______ NA个氧原子数;1mol37Cl中,中子数比质子数多_______ NA个;1L 1mol/LFe2(SO4)3溶液中含_____NA个SO42-离子。
(2)图中A、B分别是某微粒的结构示意图,回答下列问题: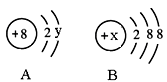
①若A表示某元素的原子,则y= 。
②若B表示某稀有气体元素的原子,则该元素的单质的化学式为 ,若B是阴离子的结构示意图,则x的取值范围是________________。
(3)RxO42-中R的化合价为___________(用含x 的式子表示),当0.3 mol RxO42-完全反应,生成RO2时,转移0.6 mol电子,则x=__________。
(4)将7.8 g镁铝合金与100mL 稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐46.2 g,则原硫酸的物质的量浓度为______________。
(1)2,2,3,3(每空均为1分)
(2)①6(1分);②Ar(1分,写名称不得分),14≤x≤17
(3)+6/x; 1或2(答对一个得1分) (4)4mol/L(无单位扣1分)
解析试题分析:(1)乙烯和环丁烷(C4H8)的最简式都是CH2,所以28g乙烯和环丁烷(C4H8)的混合气体中碳原子的物质的量=28g÷14g/mol=2mol。因此若NA表示阿伏加德罗常数,则28g乙烯和环丁烷(C4H8)的混合气体中含有2NA个碳原子;分子总数为NA个的NO2和CO2混合气体的物质的量是1mol,由于NO2和CO2均是含有2个氧原子的,所以分子总数为NA个的NO2和CO2混合气体含2NA个氧原子数;在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。因为质子数和中子数之和是质量数,所以1mol37Cl中,中子数比质子数多(37-17-17)×NA=3 NA个;1L 1mol/LFe2(SO4)3溶液中溶质硫酸铁的物质的量=1L×1mol/L=1mol,在溶液中硫酸铁的电离方程式为Fe2(SO4)3=2Fe3++3SO42-,所以溶液中含3NA个SO42-离子。
(2)①若A表示某元素的原子,则核外电子数=质子数,即2+y=8,所以y=6。
②若B表示某稀有气体元素的原子,则该元素的质子数=2+8+8=18,因此则该元素是Ar,其的单质的化学式为Ar。若B是阴离子的结构示意图,则B是第三周期的非金属,因此x的取值范围是14≤x≤17。
(3)氧元素的化合价是-2价,则 RxO42-中R的化合价为+(8-2)÷x=+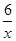 (用含x 的式子表示)。当0.3 mol RxO42-完全反应,生成RO2时,转移0.6 mol电子。由于RO2中R元素的化合价是+4价,如果反应中R元素的化合价从+
(用含x 的式子表示)。当0.3 mol RxO42-完全反应,生成RO2时,转移0.6 mol电子。由于RO2中R元素的化合价是+4价,如果反应中R元素的化合价从+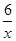 降低到+4价,则0.3mol×(
降低到+4价,则0.3mol×(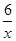 -4)×x=0.6mol,解得x=1。如果反应中R元素的化合价从+
-4)×x=0.6mol,解得x=1。如果反应中R元素的化合价从+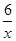 升高到+4价,则0.3mol×(4-
升高到+4价,则0.3mol×(4-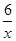 )×x=0.6mol,解得x=2。
)×x=0.6mol,解得x=2。
(4) 将7.8 g镁铝合金与100mL 稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐46.2 g,则根据原子守恒可知,硫酸盐中SO42-的质量=46.2g-7.8g=38.4g,物质的量=38.4g÷96g/mol=0.4mol,因此原硫酸的物质的量也是0.4mol,其浓度=0.4mol÷0.1L=4.0mol/L。
考点:考查物质的量、物质的量浓度以及化合价的有关计算;微粒结构示意图的应用与判断

 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案现用98%的浓H2SO4(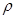 =1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸500mL。
=1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸500mL。
(1)请将下列操作按正确的序号填在横线上:
| A.用量筒量取浓H2SO4 |
| B.反复颠倒摇匀 |
| C.用胶头滴管加水至刻度 |
| D.洗净烧杯内壁和玻璃棒,并将洗液转至容量瓶 |
F.将溶液转入容量瓶
其操作正确顺序为_____________
(2)简要回答下列问题:
①所需浓H2SO4的体积为________mL。
②如果实验室有15mL, 20mL, 25mL的量筒,选用_______mL的量筒最好。量取时发现量筒不干净,用水洗净后直接量取将使实验最终结果______(填“偏高”、“偏低”或“无影响”)。
③将浓H2SO4沿烧杯内壁慢慢注入盛水的烧杯中,不断搅拌的目的是_______,若搅拌过程中有液体溅出,会使最终结果_______(填“偏高”、“偏低”或“无影响”)。
④在转入容量瓶前烧杯中液体应_______,否则会使浓度_______;洗涤烧杯2~3次,洗液也要转入容量瓶,否则会使最终结果_______(填“偏高”、“偏低”或“无影响”)。
⑤定容时必须使溶液凹液面与刻度线相切,若俯视会使结果_______,仰视会使结果_______(填“偏高”、“偏低”或“无影响”)。
