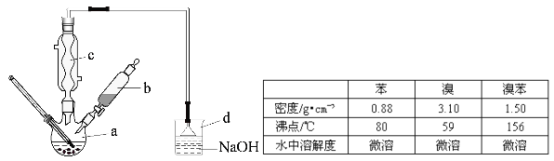
题目内容
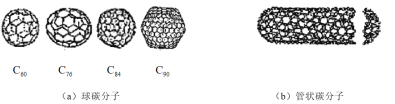
【题目】在20世纪90年代末,科学家发现碳有新的单质形态![]() 存在。后来人们又相继得到了
存在。后来人们又相继得到了![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关碳元素单质的说法错误的是
等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关碳元素单质的说法错误的是
A.金刚石和石墨的熔点肯定比![]() 高
高
B.熔点:![]()
C.球碳分子、管状碳分子和洋葱状碳分子都是分子晶体,都是碳的同素异形体
D.金刚石以非分子形式的粒子存在,属于原子晶体;![]() 、
、![]() 、管状碳分子和洋葱状碳分子以分子形式的粒子存在,属于分子晶体;这些碳单质不互为同素异形体
、管状碳分子和洋葱状碳分子以分子形式的粒子存在,属于分子晶体;这些碳单质不互为同素异形体
【答案】D
【解析】
A.金刚石属于原子晶体,石墨属于混合晶体,C60属于分子晶体,因此金刚石和石墨的熔点肯定要比C60高,故A正确;
B.分子晶体的相对分子质量越大,熔点越高,因此熔点:![]() ,故B正确;
,故B正确;
C.球碳分子、管状碳分子和洋葱状碳分子都是碳元素形成的不同单质,所以均为碳的同素异形体,故C正确;
D.金刚石属于原子晶体,不存在分子;![]() 、
、![]() 、管状碳分子和洋葱状碳分子都是分子晶体,以分子形式存在;都是碳元素形成的不同单质,互为同素异形体,故D错误;
、管状碳分子和洋葱状碳分子都是分子晶体,以分子形式存在;都是碳元素形成的不同单质,互为同素异形体,故D错误;
故选D。

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3)![]() 0.1 mol/L
0.1 mol/L
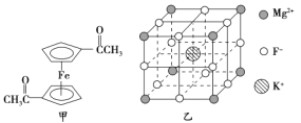
【题目】有![]() 、
、![]() 、
、![]() 三种晶体,分别由
三种晶体,分别由![]() 、
、![]() 、
、![]() 、
、![]() 四种元素中的一种或几种形成,对这三种晶体进行实验,结果如表所示。
四种元素中的一种或几种形成,对这三种晶体进行实验,结果如表所示。
晶体 | 熔点/℃ | 硬度 | 水溶性 | 导电性 | 水溶液与 |
| 801 | 较大 | 易溶 | 水溶液(或熔融)导电 | 白色沉淀 |
| 3500 | 很大 | 不溶 | 不导电 | 不反应 |
|
| 很小 | 易溶 | 液态不导电 | 白色沉淀 |
(1)晶体的化学式分别为![]() ______;
______;![]() ______。
______。
(2)晶体的类型分别为![]() ______;
______;![]() ______,
______,![]() ______。
______。
(3)![]() 、
、![]() 晶体中粒子间的作用力分别为______、______。
晶体中粒子间的作用力分别为______、______。
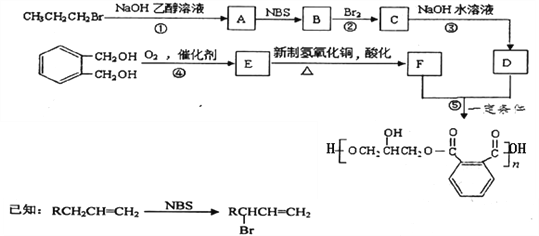
【题目】某学生为探究AgCl沉淀的溶解和转化,其实验方案及记录如下:
步骤和现象 | 现象 |
Ⅰ.将等体积等浓度的AgNO3溶液和NaCl溶液混合,过滤,得滤液X和白色沉淀Y | |
Ⅱ.向滤液X 中滴加几滴饱和KI溶液 | 生成黄色沉淀M |
Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S溶液 | 沉淀Y 转化为黑色沉淀Z |
Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水 | 沉淀Y逐渐溶解 |
(1)由步骤Ⅱ的现象可推测,滤液 X 中除了含有Na+、NO3-,还含有的离子有_____。
(2)写出步骤Ⅲ中生成黑色沉淀 Z 的离子方程式为_________________,白色沉淀Y 转化为黑色沉淀 Z 的主要原因是___________。
(3)已知:Ag+ + 2NH3· H2OAg(NH3)2++2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因__________________。
(4)为了进一步探究银的难溶化合物沉淀溶解的多样性,该同学又做了如下对比实验 V:
①取少量黑色沉淀 Z 和黄色沉淀 M,分置于两支试管中
②然后分别滴加同体积同浓度的稀硝酸,观察到黄色沉淀 M 不溶解,黑色沉淀 Z 溶解,并且有无色气体产生。综合实验Ⅱ至实验 V 的信息,下列预测正确的是__________
A.黑色沉淀 Z 比黄色沉淀 M 更难溶于水
B.黑色沉淀 Z 溶解于稀硝酸是因为发生了氧化还原反应
C.由步骤Ⅳ可以推测:实验室可用氨水洗涤银镜反应后的试管
D.在步骤Ⅳ之后,继续滴加浓硝酸后又有 AgCl 沉淀生成